题目内容
高铁酸盐在能源环保领域有广泛用途。用镍(Ni)、铁做电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示。下列推断合理的是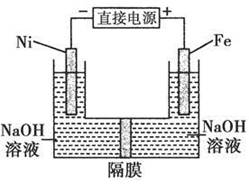
A.铁是阳极,电极反应为Fe-6e-+4H2O= +8H+ +8H+ |
| B.镍电极上的电极反应为2H++2e-=H2↑ |
| C.若隔膜为阴离子交换膜,则OH-自右向左移动 |
| D.电解时阳极区pH降低、阴极区pH升高,最终溶液pH不变 |
B
解析A选项,Fe与电源的正极相连,故Fe为阳极,阳极发生氧化反应,因电解质溶液呈碱性,故不能得到H+,正确的阳极反应式为Fe-6e-+8OH-= +4H2O;B选项,Ni电极为阴极,在阴极,水电离出的H+发生还原反应生成H2; C选项,由电极反应式知OH-由左(阴极)向右(阳极)移动;D选项,阳极区消耗OH-,pH减小,阴极区生成OH-,pH增大,由总反应式:Fe+2OH-+2H2O=
+4H2O;B选项,Ni电极为阴极,在阴极,水电离出的H+发生还原反应生成H2; C选项,由电极反应式知OH-由左(阴极)向右(阳极)移动;D选项,阳极区消耗OH-,pH减小,阴极区生成OH-,pH增大,由总反应式:Fe+2OH-+2H2O= +3H2↑可知,整个溶液碱性减小,pH减小。
+3H2↑可知,整个溶液碱性减小,pH减小。

练习册系列答案
相关题目
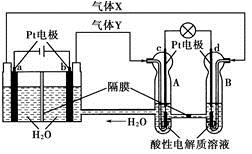
如图所示,通电一段时间后,Cu电极增重2.16 g,同时在A池中收集到标准状况下的气体224 mL,设A池中原混合液的体积为100 mL,则通电前A池中原混合溶液Cu2+的浓度为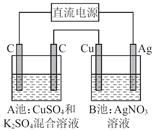
| A.0.05 mol/L | B.0.035 mol/L | C.0.025 mol/L | D.0.020 mol/L |
下图为两个原电池装置图,由此判断下列说法错误的是( )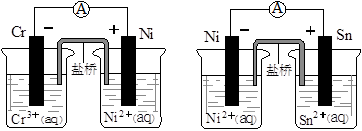
| A.当两电池转移相同电子时,生成和消耗Ni的物质的量相同 |
| B.两装置工作时,盐桥中的阴离子向负极移动,阳离子向正极移动 |
| C.由此可判断能够发生2Cr3++3Ni=3Ni2++2Cr和Ni2++Sn=Sn2++Ni的反应 |
| D.由此可判断Cr、Ni、Sn三种金属的还原性强弱顺序为:Cr>Ni>Sn |
下列叙述正确的是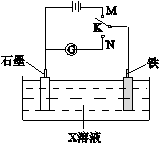
| A.K与N连接时,X为硫酸,一段时间后溶液的pH增大 |
| B.K与N连接时,X为氯化钠,石墨电极反应:2H++2e—=H2↑ |
| C.K与M连接时,X为硫酸,一段时间后溶液的pH增大 |
| D.K与M连接时,X为氯化钠,石墨电极反应:4OH—-4e—=2H2O+O2↑ |
控制适合的条件,将反应2Fe3++2I- 2Fe2++I2设计成如下图所示的原电池。下列判断不正确的是
2Fe2++I2设计成如下图所示的原电池。下列判断不正确的是
| A.反应开始时,乙中石墨电极上发生氧化反应 |
| B.反应开始时,甲中石墨电极上Fe3+被还原 |
| C.电流计读数为零时,反应达到化学平衡状态 |
| D.电流计读数为零后,在甲中溶入FeCl2固体,乙中的石墨电极为负极 |
研究人员最近发明了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl。下列“水”电池在海水中放电时的有关说法正确的是
| A.正极反应式:Ag+Cl--e-=AgCl |
| B.每生成1 mol Na2Mn5O10转移2 mol电子 |
| C.Na+不断向“水”电池的负极移动 |
| D.AgCl是还原产物 |
目前人们掌握了可充电锌—空气电池技术,使这种电池有了更广泛的用途。这种电池使用特殊技术吸附空气中的氧,以苛性钠溶液为电解质,电池放电时的总反应为2Zn+O2=2ZnO,下列判断正确的是
| A.放电时,OH-向负极方向移动 |
| B.放电时,正极反应式为Zn+2OH--2e-=ZnO+H2O |
| C.充电时,Zn发生氧化反应 |
| D.充电时,阴极反应为O2+2H2O+4e-=4OH- |
以KCl和ZnCl2混合液为电镀液在铁制品上镀锌,下列说法正确的是( )
| A.未通电前上述镀锌装置可构成原电池,电镀过程是该原电池的充电过程 |
| B.因部分电能转化为热能,电镀时通过的电量与锌的析出量无确定关系 |
| C.电镀时保持电流恒定,升高温度不改变电解反应速率 |
| D.镀锌层破损后即对铁制品失去保护作用 |