题目内容
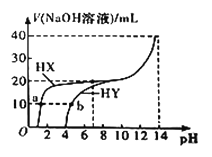
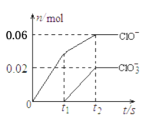
【题目】将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有3种含氯元素的离子,其中ClO-和ClO![]() 两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示。下列说法正确的是
两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示。下列说法正确的是
A.苛性钾中KOH的物质的量为0.24mol
B.反应中转移电子的物质的量是0.21mol
C.有2.688L氯气参与反应
D.酸性条件下ClO-和ClO![]() 可生成Cl2
可生成Cl2
【答案】A
【解析】
由信息可知,氯气和氢氧化钾溶液反应生成次氯酸钾、氯化钾和氯酸钾,根据图象可知完全反应时溶液中n(ClO-)=0.06mol、n(ClO3-)=0.02mol,根据得失电子数目守恒可知反应生成的氯离子n(Cl-)=0.06mol×(1-0)+0.02mol×(5-0)=0.16mol,根据物料守恒可知n(K+)=n(Cl-)+n(ClO-)+n(ClO3-)=0.16mol+0.06mol+0.02mol=0.24mol。
A.由分析可知,溶液中n(K+)=0.24mol,由钾原子个数守恒可知,苛性钾中KOH的物质的量为0.24mol,故A正确;
B.根据图象可知完全反应时溶液中n(ClO-)=0.06mol、n(ClO3-)=0.02mol,反应中转移电子的物质的量是0.06mol×(1-0)+0.02mol×(5-0)=0.16mol,故B错误;
C.由分析可知,溶液中n(ClO-)=0.06mol、n(ClO3-)=0.02mol、n(Cl-)=0.16mol,由物料守恒可知参加反应的氯气的物质的量为![]() =0.12mol,标准状况下体积为0.12mol ×22.4L/mol=2.688L,因没有明确是否为标准状况,则无法计算0.12mol氯气体积,故C错误;
=0.12mol,标准状况下体积为0.12mol ×22.4L/mol=2.688L,因没有明确是否为标准状况,则无法计算0.12mol氯气体积,故C错误;
D.ClO-和ClO![]() 中氯元素化合价都大于0,按照氧化还原反应规律,两者不可能发生氧化还原反应生成氯气,故D错误;
中氯元素化合价都大于0,按照氧化还原反应规律,两者不可能发生氧化还原反应生成氯气,故D错误;
故选A。

 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案【题目】某化工小组研究银铜复合废料(表面变黑,生成Ag2S)回收银单质及制备硫酸铜晶体,工艺如下:(废料中的其他金属含量较低,对实验影响可忽略)
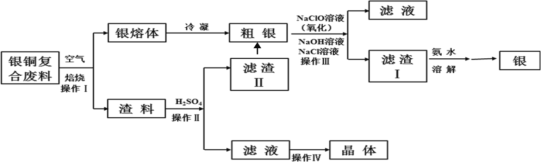
已知:①AgCl可溶于氨水,生成[Ag(NH3)2]+;
②Ksp(Ag2SO4)=1.2×105,Ksp(AgCl)=1.8×1010;
③渣料中含有少量银和硫酸银(微溶)。
(1)操作I中为了加快空气熔炼速率,可以采取_______措施(写出其中一种即可)。
(2)操作IV经过________、_______过滤、洗涤和干燥,可以得到硫酸铜晶体。
(3)洗涤滤渣II,与粗银合并,目的是__________。
(4)操作III中,NaClO溶液与Ag反应的产物为AgCl、NaOH、NaCl和O2,该反应的化学方程式为______(其中AgCl和NaCl的物质的量之比为2∶1)。氧化的同时发生沉淀转化,离子方程式为_____,其平衡常数K=__________。
(5)在空气中加热5.20g硫酸铜晶体(CuSO4·5H2O)样品,受热过程中不同温度范围内分别得到一种固体物质,其质量如表。(已知CuSO4·5H2O相对分子质量250)
温度范围/℃ | 固体质量/g |
200~260 | 3.33 |
650~800 | 1.67 |
1000~1500 | 1.50 |
加热到1000℃时,固体物质的化学式为:_______。