题目内容
【题目】25℃时,体积均为20 mL、浓度均为0.1mol/L的两种酸HX、HY分别与0.1mol/L的NaOH溶液反应,所加NaOH溶液体积与反应后溶液的pH的关系如图所示。下列叙述正确的是( )
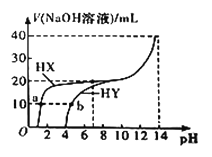
A. 加入10 mL NaOH溶液时,a点c(X)<b点c(Y)
B. HY中加NaOH溶液至pH=7时,所得溶液中c(Y)=c(Na+)=c(OH)=c(H+)
C. b点溶液中,c(Y)+2c(OH)=c(HY)+2c(H+)
D. 25℃时,HX为强酸,HY为弱酸且Ka=108
【答案】C
【解析】
根据图中信息可知,浓度均为0.1mol/L的两种酸HX、HY的pH分别为1和4,则HX为强酸,HY为弱酸。
A.加入10mLNaOH溶液时,a点得到等物质的量浓度的HX和NaX的混合液,b点得到等物质的量浓度的HY和NaY的混合液,且a、b点溶液中Na+浓度相等,由于HX为强酸,HY为弱碱,所以a点的c(X-)大于b点的c(Y-),A项错误;
B.HY溶液中加入NaOH溶液至pH=7时,此时溶液中有c(H+)=c(OH-),依据电荷守恒有:c(Na+)+c(H+)=c(OH-)+c(Y-),所以有c(Na+)=c(Y-),此时该溶液中离子浓度的关系:c(Na+)=c(Y-)>c(H+)=c(OH-),B项错误;
C.b点溶液中,依据电荷守恒有:c(Na+)+c(H+)=c(OH-)+c(Y-)①,依据物料守恒有:2c(Na+)=c(Y-)+c(HY)②,将①式乘以2,再与②式相减消去c(Na+)可得题给等式,C项正确;
D.HX为强酸,HY为弱酸,没有加入NaOH溶液时,0.1mol/LHY溶液的pH=4,c(Y-)=c(H+)=10-4mol/L,则Ka=![]() =
=![]() =1×10-7,D项错误;
=1×10-7,D项错误;
所以答案选择C项。

 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
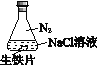
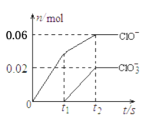
同步奥数系列答案【题目】研究生铁的锈蚀,下列分析不正确的是
序号 | ① | ② | ③ |
实验 |
|
|
|
现象 | 8小时未观察 到明显锈蚀 | 8小时未观察 到明显锈蚀 | 1小时观察 到明显锈蚀 |
A. ①中,NaCl溶液中溶解的O2不足以使生铁片明显锈蚀
B. ②中,生铁片未明显锈蚀的原因之一是缺少H2O
C. ③中正极反应:O2+4e+ 2H2O ==4OH
D. 对比①②③,说明苯能隔绝O2