题目内容
10.下列实验不能作为判断依据的是( )| A. | 钠和镁分别与冷水反应,判断钠和镁金属性强弱 | |
| B. | Br2与I2分别与足量的H2反应,判断溴与碘的非金属性强弱 | |
| C. | 硅酸钠溶液中通入CO2产生白色沉淀,判断碳酸与硅酸的酸性强弱 | |
| D. | 在MgCl2与AlCl3溶液中分别加入过量的氨水,判断镁与铝的金属性强弱 |
分析 A、金属与水反应置换出氢气的难易程度,能判断金属性的强弱;
B、非金属与氢气化合的难易程度及非金属最高价氧化物对应的水化物的酸性,来判断非金属性的强弱;
C、碳酸的酸性大于硅酸,发生强酸制取弱酸的反应;
D、元素的金属性越强,其最高价氧化物的水化物碱性越强.
解答 解:A、钠与冷水比镁与冷水反应剧烈,因此钠的金属性强于镁,故A正确;
B、卤素单质与氢气化合越容易,非金属性越强,故B正确;
C、CO2通入硅酸钠溶液,发生强酸制取弱酸的反应,生成硅酸沉淀,可知碳酸的酸性大于硅酸,故C正确;
D、元素的金属性越强,其最高价氧化物的水化物碱性越强,氨气和氯化镁、氯化铝溶液都反应生成氢氧化镁、氢氧化铝沉淀,不能确定氢氧化铝、氢氧化镁碱性强弱,则不能确定两种金属的金属性强弱,故D错误.
故选D.
点评 本题考查判断金属性强弱的方法.判断金属性的方法很多,只要合理即可.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
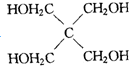
20. “神十”宇航员使用的氧气瓶是以聚酯玻璃钢为原料.甲、乙、丙三种物质是合成聚酯玻璃钢的基本原料.下列说法错误的是( )
“神十”宇航员使用的氧气瓶是以聚酯玻璃钢为原料.甲、乙、丙三种物质是合成聚酯玻璃钢的基本原料.下列说法错误的是( )
 “神十”宇航员使用的氧气瓶是以聚酯玻璃钢为原料.甲、乙、丙三种物质是合成聚酯玻璃钢的基本原料.下列说法错误的是( )
“神十”宇航员使用的氧气瓶是以聚酯玻璃钢为原料.甲、乙、丙三种物质是合成聚酯玻璃钢的基本原料.下列说法错误的是( )| A. | 甲物质在一定条件下可以生成有机高分子化合物 | |
| B. | 1mol乙物质可与2mol钠完全反应生成1mol氢气 | |
| C. | 甲、丙物质都能使溴的四氯化碳溶液褪色 | |
| D. | 甲在酸性条件下水解产物之一与乙互为同系物 |
1.短周期主族元素X、Y、Z在周期表中的位置如图.下列说法正确的是( )
| Z | |
| X | Y |
| A. | Z元素的最高化合价一定大于X元素 | |
| B. | 三种元素原子半径由高到低的顺序一定是Y>X>Z | |
| C. | 若它们的原子最外层电子数之和为11,则X为金属元素 | |
| D. | 若它们均为金属元素,则Y的最高价氧化物对应水化物的碱性最强 |
15.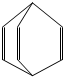 烯料是人们装修房屋时常用的物质,其中桶烯就是其中倍受青睐的一种,其结构简式如图所示,有关桶烯说法不正确的是( )
烯料是人们装修房屋时常用的物质,其中桶烯就是其中倍受青睐的一种,其结构简式如图所示,有关桶烯说法不正确的是( )
 烯料是人们装修房屋时常用的物质,其中桶烯就是其中倍受青睐的一种,其结构简式如图所示,有关桶烯说法不正确的是( )
烯料是人们装修房屋时常用的物质,其中桶烯就是其中倍受青睐的一种,其结构简式如图所示,有关桶烯说法不正确的是( )| A. | 不慎将桶烯撒倒地面瓷砖上,可用火烤干 | |
| B. | 1mol桶烯在一定条件下能与3molCl2发生加成反应 | |
| C. | 桶烯与苯乙烯互为同分异构体 | |
| D. | 桶烯可用做其它有机涂料的溶剂 |
19.镭是元素周期表中第七周期第ⅡA族元素,关于其叙述不正确的是( )
| A. | 镭的金属性比钙弱 | B. | 单质能与水反应生成氢气 | ||
| C. | 在化合物中呈+2价 | D. | 碳酸镭难溶于水 |
20.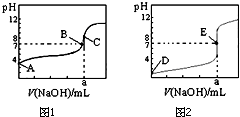 如图1、2为常温下用0.10mol•L-1 NaOH溶液滴定20.00mL 0.10mol•L-1 盐酸和20.00mL 0.10mol•L-1醋酸的曲线.若以HA表示酸,下列判断和说法正确的是( )
如图1、2为常温下用0.10mol•L-1 NaOH溶液滴定20.00mL 0.10mol•L-1 盐酸和20.00mL 0.10mol•L-1醋酸的曲线.若以HA表示酸,下列判断和说法正确的是( )
 如图1、2为常温下用0.10mol•L-1 NaOH溶液滴定20.00mL 0.10mol•L-1 盐酸和20.00mL 0.10mol•L-1醋酸的曲线.若以HA表示酸,下列判断和说法正确的是( )
如图1、2为常温下用0.10mol•L-1 NaOH溶液滴定20.00mL 0.10mol•L-1 盐酸和20.00mL 0.10mol•L-1醋酸的曲线.若以HA表示酸,下列判断和说法正确的是( )| A. | 图1是滴定盐酸的曲线 | |
| B. | E点时溶液中离子浓度为c(Na+ )=c(A- ) | |
| C. | B点时,反应消耗溶液体积:V(NaOH)>V(HA) | |
| D. | 当0mL<V(NaOH)<20.00mL时,溶液中一定是c(A-)>c(Na+ )>c(H+ )>c(OH- ) |
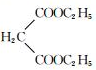 $→_{CH_{3}CH_{2}ONa}^{BrCH_{2}CH_{2}CH_{2}Br}$
$→_{CH_{3}CH_{2}ONa}^{BrCH_{2}CH_{2}CH_{2}Br}$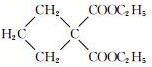 $→_{ii.H+/△}^{i.H_{2}O,OH-}$
$→_{ii.H+/△}^{i.H_{2}O,OH-}$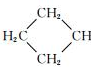 -COOH
-COOH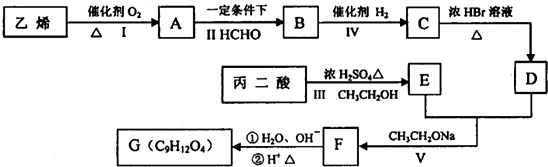
 G
G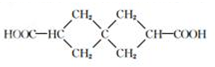
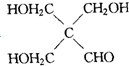
 例如:
例如:
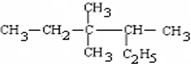 的名称3,3,4-三甲基己烷
的名称3,3,4-三甲基己烷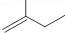 的名称2-甲基-1-丁烯.
的名称2-甲基-1-丁烯.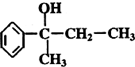 在工业上用基础的石油产品(乙烯、丙烯等)进行合成.合成A的过程可表示为:
在工业上用基础的石油产品(乙烯、丙烯等)进行合成.合成A的过程可表示为: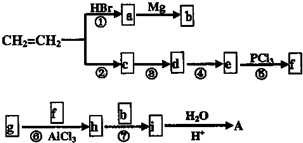

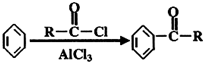
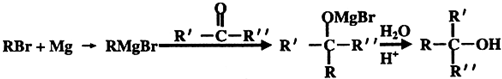
 ;
;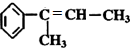 .
.