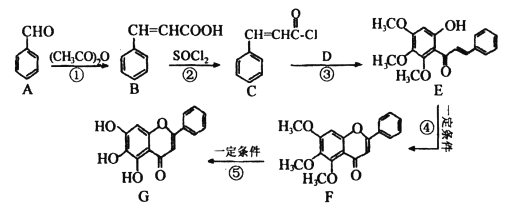
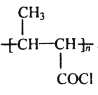
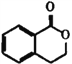
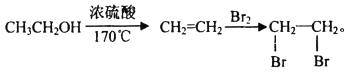题目内容
【题目】下列关于原电池的说法中,正确的是( )
A.任何化学反应上都能设计成原电池
B.原电池工作时,阳离子向负极移动
C.原电池的负极发生氧化反应
D.原电池工作时,电子通过电解质溶液流向正极
【答案】C
【解析】
A.自发进行的放热的氧化还原反应能设计成原电池,非氧化还原反应一定不能设计成原电池,故A错误;
B.原电池工作时,溶液中的阳离子向正极移动,阴离子向负极移动,故B错误;
C.原电池工作时,负极发生氧化反应,正极发生还原反应,故C正确;
D.原电池工作时,电子从负极经导线流向正极,溶液中存在离子的定向迁移,电解质溶液中不存在电子的移动,故D错误;
答案选C。

 新思维寒假作业系列答案
新思维寒假作业系列答案【题目】(2018·安徽省合肥市高三第三次教学质量检测)H2S在重金属离子处理、煤化工等领域都有重要应用。请回答:
Ⅰ.H2S是煤化工原料气脱硫过程的重要中间体,反应原理为
ⅰ.COS(g)+H2(g)![]() H2S(g)+CO(g)△H=+7kJ·mol1
H2S(g)+CO(g)△H=+7kJ·mol1
ⅱ.CO(g)+H2O(g)![]() CO2(g)+H2(g)△H=42kJ·mol1
CO2(g)+H2(g)△H=42kJ·mol1
已知断裂1mol气态分子中的化学键所需能量如下表所示。
分子 | COS(g) | H2(g) | CO(g) | H2S(g) |
能量(kJ·mol1) | 1310 | 442 | x | 669 |
(1)计算表中x=_______。
(2)T℃时,向VL容积不变的密闭容器中充入1mol COS(g)、1mol H2(g)和1mol H2O(g),发生上述两个反应。
①在T℃时测得平衡体系中COS为0.80 mol,H2为0.85 mol,则T℃时反应ⅰ的平衡常数K=_______(保留2位有效数字)。
②上述反应达平衡后,若向其中再充入1mol COS(g)、1molH2(g)和1mol H2O(g),则再次达平衡后H2的体积分数_______(填“增大”、“减小”或“不变”);若升高温度,则CO的平衡体积分数_______(填“增大”、“减小”或“不变”),其理由是_______。
Ⅱ.H2S在高温下分解制取H2,同时生成硫蒸气。
(3)向2L密闭容器中加入0.2molH2S,反应在不同温度(900~1500℃)下达到平衡时,混合气体中各组分的体积分数如下图所示,则在此温度区间内,H2S分解反应的主要化学方程式为_______;在1300℃时,反应经2min达到平衡,则0~2min的反应速率v(H2S)=_______。
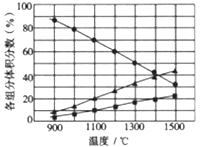
Ⅲ.H2S用作重金属离子的沉淀剂。
(4)25℃时,向浓度均为0.001mol·L1Sn2+和Ag+的混合溶液中通入H2S,当Sn2+开始沉淀时,溶液中c(Ag+)=_______。(已知:25℃时,Ksp(SnS)=1.0×1025,Ksp(Ag2S)=1.6×1049)。