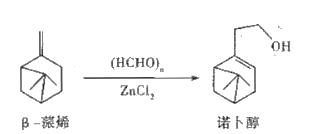
题目内容
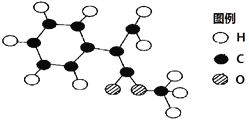
【题目】有关如下所示化合物的说法不正确的是( )

A. 既可以与Br2的CCl4溶液发生加成反应,又可以在光照下与Br2发生取代反应
B. 1mol该化合物最多可以与3molNaOH反应
C. 既可以催化加氢,又可以使酸性KMnO4溶液褪色
D. 既可以与FeCl3溶液发生显色反应,又可以与NaHCO3溶液反应放出CO2气体
【答案】D
【解析】A、有机物含有碳碳双键,故可以与Br2发生加成反应,又含有甲基,故可以与Br2光照发生取代反应,故A正确;B、酚羟基要消耗一个NaOH,两个酯基要消耗两个NaOH,1mol该化合物最多可以与3molNaOH反应,故B正确;C、苯环可以催化加氢,碳碳双键可以使KMnO4褪色,故C正确;D、该有机物中不存在羧基,并且酚羟基酸性比碳酸弱,故不能与NaHCO3放出CO2气体,故D错误;故选D。

【题目】(2018·安徽省合肥市高三第三次教学质量检测)H2S在重金属离子处理、煤化工等领域都有重要应用。请回答:
Ⅰ.H2S是煤化工原料气脱硫过程的重要中间体,反应原理为
ⅰ.COS(g)+H2(g)![]() H2S(g)+CO(g)△H=+7kJ·mol1
H2S(g)+CO(g)△H=+7kJ·mol1
ⅱ.CO(g)+H2O(g)![]() CO2(g)+H2(g)△H=42kJ·mol1
CO2(g)+H2(g)△H=42kJ·mol1
已知断裂1mol气态分子中的化学键所需能量如下表所示。
分子 | COS(g) | H2(g) | CO(g) | H2S(g) |
能量(kJ·mol1) | 1310 | 442 | x | 669 |
(1)计算表中x=_______。
(2)T℃时,向VL容积不变的密闭容器中充入1mol COS(g)、1mol H2(g)和1mol H2O(g),发生上述两个反应。
①在T℃时测得平衡体系中COS为0.80 mol,H2为0.85 mol,则T℃时反应ⅰ的平衡常数K=_______(保留2位有效数字)。
②上述反应达平衡后,若向其中再充入1mol COS(g)、1molH2(g)和1mol H2O(g),则再次达平衡后H2的体积分数_______(填“增大”、“减小”或“不变”);若升高温度,则CO的平衡体积分数_______(填“增大”、“减小”或“不变”),其理由是_______。
Ⅱ.H2S在高温下分解制取H2,同时生成硫蒸气。
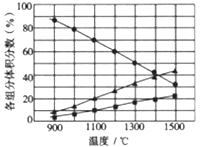
(3)向2L密闭容器中加入0.2molH2S,反应在不同温度(900~1500℃)下达到平衡时,混合气体中各组分的体积分数如下图所示,则在此温度区间内,H2S分解反应的主要化学方程式为_______;在1300℃时,反应经2min达到平衡,则0~2min的反应速率v(H2S)=_______。
Ⅲ.H2S用作重金属离子的沉淀剂。
(4)25℃时,向浓度均为0.001mol·L1Sn2+和Ag+的混合溶液中通入H2S,当Sn2+开始沉淀时,溶液中c(Ag+)=_______。(已知:25℃时,Ksp(SnS)=1.0×1025,Ksp(Ag2S)=1.6×1049)。
【题目】氯苯是燃料、医药、有机合成的中间体,是重要的有机化工产品。实验室制取氯苯的装置如图所示(加热和固定仪器的装置略去)。回答下列问题:
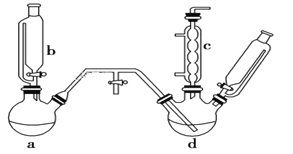
(1)a和b仪器组合成制取氯气的装置,反应无需加热,则a装置中的固体反应物可以是________(填字母序号)。
A.MnO2 B.KMnO4 C.K2Cr2O7
(2)把氯气通入反应器d中(d装置有FeCl3和苯),加热维持反应温度40~60 ℃,温度过高会生成过多的二氯苯。对d加热的方法是______________________。
(3)装置c出口的气体成分有HCl、Cl2、水蒸气和_____。
(4)制取氯苯的化学方程式为_______________________ 。
(5)装置d中的反应完成后,工业上要进行水洗、碱洗及食盐干燥,才能蒸馏。
①碱洗之前要水洗,其目的是______________________________。
②用10%NaOH溶液碱洗时发生氧化还原反应的化学反应方程式为_____________________。
(6)生成的氯气中存在HCl、H2O等杂质气体,若需要增加一个装置除去水蒸气,请画出该装置图,并标明所用试剂________。
(7)工业生产中苯的流失情况如下表所示:
项目 | 二氯苯 | 氯化尾气 | 蒸气 | 成品 | 不确定苯耗 | 合计 |
苯流失量kg/t | 11.7 | 5.4 | 20.8 | 2.0 | 49.3 | 89.2 |
则10t苯可制得成品氯苯________t(列出计算式即可。氯苯和苯的相对分子质量分别是112.5和78)。