题目内容
11.有下列物质:(1)熔融硝酸钾;(2)乙醇;(3)氢氧化钠固体(4)氨水;(5)铜;(6)硫酸钡;(7)盐酸;(8)石墨;(9)二氧化硫(10)冰醋酸.其中能导电的是(1)(4)(5)(7)(8),(用序号填写,下同)属于强电解质的是(1)(3)(6),属于弱电解质的是(10),属于非电解质的是(2)(9).
分析 在水溶液里或熔融状态下能导电的化合物是电解质,在水溶液里和熔融状态下都不导电的化合物是非电解质,完全电离的电解质是强电解质,部分电离的电解质是弱电解质,能导电的物质中含有自由移动的电子或离子.
解答 解:(1)熔融硝酸钾能导电,属于盐,是强电解质;(2)乙醇不能导电,属于非电解质;(3)氢氧化钠固体不能导电,但是溶于水或者熔融状态下完全电离,属于强电解质;(4)氨水能导电,但是属于混合物,既不是电解质也不是非电解质;(5)铜能导电,属于单质,既不是电解质也不是非电解质;(6)硫酸钡不能导电,属于盐,熔融状态下完全电离,属于强电解质;(7)盐酸能导电,属于混合物,既不是电解质也不是非电解质;(8)石墨能导电,属于单质,既不是电解质也不是非电解质;(9)二氧化硫不能导电,本身不能电离,属于非电解质;(10)冰醋酸不能导电,溶于水能部分电离,属于弱电解质,
故答案为:(1)(4)(5)(7)(8);(1)(3)(6);(10);(2)(9).
点评 本题考查了电解质、非电解质、强弱电解质的判断,难度不大,注意这几个概念的区别.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
2.燃烧垃圾能产生空气污染物和某些致癌物质,下列物质中极易使人致癌的是( )
| A. | 一氧化碳 | B. | 二氧化碳 | C. | 氯化氢 | D. | 二噁英 |
19.已知H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol.下列关于中和热的说法中正确的是( )
| A. | 在稀溶液中所有酸和碱反应的中和热数值都相等 | |
| B. | 在稀溶液中1 mol酸和1 mol碱反应放出的热量都相等 | |
| C. | 在稀溶液中HCl和NaOH反应、HNO3和KOH反应的中和热相等 | |
| D. | 将浓硫酸滴入稍过量的氢氧化钠溶液中刚好生成1 mol水时,产生的热量即为中和热 |
16.下列反应的离子方程式中,书写正确的是( )
| A. | 实验室用大理石跟稀盐酸制取二氧化碳 2H++CO32-═CO2↑+H2O | |
| B. | 铁跟稀盐酸反应 2Fe+6H+═3H2↑+2Fe3+ | |
| C. | 氧化铝跟氢氧化钠溶液反应 Al2O3+OH-═AlO2-+H2O | |
| D. | 金属钠跟水反应 2Na+2H2O═2Na++2OH-+H2↑ |

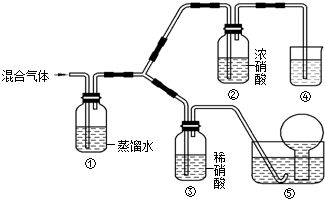
 莫尔盐[(NH4)2SO4•FeSO4•6H2O]在空气中比一般亚铁盐稳定,是化学分析中常用的还原剂.某研究性学习小组用如图所示的实验装置来制取莫尔盐,实验步骤如下:
莫尔盐[(NH4)2SO4•FeSO4•6H2O]在空气中比一般亚铁盐稳定,是化学分析中常用的还原剂.某研究性学习小组用如图所示的实验装置来制取莫尔盐,实验步骤如下: