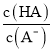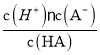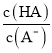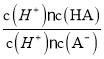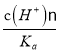题目内容
【题目】X、Y、Z、M、Q、R是6种短周期元素,其原子半径及主要化合价如下:
元素代号 | X | Y | Z | M | Q | R |
原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 | 0.037 |
主要化合价 | +2 | +3 | +6,-2 | +2 | -2 | +1 |
(1)Z在元素中期表中的位置是______________________________。
(2)X、Y、Q各自形成简单离子,其中离子半径最大的是__________(填离子符号)。
(3)周期表中有些处于对角线(左上→右下)位置的元素,它们的单质及其化合物的性质相似,则M的氧化物与强碱溶液反应的离子方程式______________________________。
(4)Q和R按原子个数比1:1组成的化合物甲是一种“绿色”氧化剂。
①甲中所含共价键类型是____________________。
②空气阴极法电解制备甲的装置如图所示。在碱性溶液中,利用空气中的氧气还原得到甲和稀碱的溶液。图中a是__________极,阴极的电极反应式是____________________。

【答案】 第3周期VIA族 O2- BeO+2OH-=BeO22-+H2O 极性共价键和非极性共价键 正 O2+2e-+2H2O=H2O2+2OH-。
【解析】本题考查元素周期表和元素周期律的应用,根据主族元素最外层电子数等于族序数,因为六种元素为短周期元素, X和M主要化合价为+2价,即位于IIA族,同主族从上到下,原子半径增大,即M为Be,X为Mg,Z和Q的最低价态为-2价,说明这两种元素位于VIA族,同主族从上到下,原子半径增大,即Q为O,Z为S,R为+1价,原子半径最小,因此推出R为H,Y的化合价为+3价,推出Y为IIIA族元素,根据原子半径大小,推出Y为Al,(1)Z为S,位于第三周期VIA族;(2)形成的简单离子分别为Mg2+、Al3+、O2-,核外电子排布相同,半径随着原子序数的递增而减小,即O2->Mg2+>Al3+,因此离子半径最大的是O2-;(3)根据所给信息,Be与Al为对角线,因此BeO具有两性,与强碱反应的离子反应方程式为BeO+2OH-=BeO22-+H2O;(4)①H和O形成1:1的化合物,即为H2O2,其结构式为H-O-O-H,含有共价键类型为极性共价键和非极性共价键;②利用信息,空气中氧气还原得到H2O2,因此氧气得到电子,即通空气一极为阴极,b为负极,a为正极,阴极反应式为O2+2H2O+2e-=H2O2+2OH-。

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案【题目】由CO和H2S反应可制得羰基硫(COS)。在恒容的密闭容器中发生反应并达到平衡:CO(g)+H2S(g) ![]() COS(g)+H2(g),数据如下表所示:
COS(g)+H2(g),数据如下表所示:
实验 | 温度/℃ | 起始时 | 平衡时 | |||
n(CO)/mol | n(H2S)/mol | n(COS)/mol | n(H2)/mol | n(CO)/mol | ||
1 | 150 | 10.0 | 10.0 | 0 | 0 | 7.0 |
2 | 150 | 7.0 | 8.0 | 2.0 | 4.5 | a |
3 | 400 | 20.0 | 20.0 | 0 | 0 | 16.0 |
下列说法正确的是( )
A. 上述反应是吸热反应
B. 实验1达平衡时,CO的转化率为70%
C. 实验2达平衡时,a<7.0
D. 实验3达平平衡后,再充入1.0molH2,平衡逆向移动,平衡常数值增大