题目内容
12.(1)配制500mL浓度为0.2mol/L的氢氧化钠溶液,需要NaOH固体4.0g,称量该固体时,应先在天平左盘放一小烧杯,称出其质量,再将NaOH固体置于其中称量.然后再烧杯里加适量水,将上述固体溶解,待冷却到室温后,再转移到500mL容量瓶中定容.(2)在(1)实验中若其他操作均正确,但定容时俯视刻度线,则所得溶液浓度大于0.2mol/L(填大于、等于或小于)
(3)在(1)实验中若NaOH溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度小于0.2mol/L(大于、等于或小于)
(4)将正确配制的上述溶液取出10mL,其浓度为0.2mol/L,所含Na+个数为0.002NA.将此10ml溶液稀释至1L,则Na+的浓度为0.002mol/L,所含Na+个数为0.002NA.
分析 (1)依据m=CVM计算需要溶质的质量;依据配制的一般步骤选择合适的仪器,依据玻璃杯在固体溶解过程中作用解答;容量瓶为精密仪器,应在规定温度下使用才标准;
(2)(3)分析不当操作对溶质的物质的量和溶液的体积的影响,依据c=$\frac{n}{V}$进行误差分析;
(4)溶液具有均一性,依据溶液稀释前后溶质的物质的量不变计算.
解答 解:(1)配制500mL浓度为0.2mol/L的氢氧化钠溶液,需要称NaOH的质量m=0.2mol/L×0.5L×40g/mol=4.0g;
配制一定物质的量浓度溶液时应烧杯中溶解,应选择500mL容量瓶配制,容量瓶使用时,溶液应冷却到室温,定容时,先加入蒸馏水到离刻度线1-2cm时,改用胶头滴管逐滴滴加到凹液面的最低点与刻度线相切;
故答案为:4.0;烧杯;冷却到室温;500mL容量瓶;
(2)定容时俯视刻度线,导致溶液的体积偏小,溶液的浓度偏高,故答案为:大于;
(3)实验中若NaOH溶液在转移至容量瓶时,洒落了少许,导致溶质的物质的量偏小,溶液的浓度偏低,故答案为:小于;
(4)溶液具有均一性,溶液的浓度与所取的体积无关,所以将正确配制好的上述溶液取出10mL,其物质的量浓度为0.2mol/L;
所含Na+个数为0.01L×0.2mol/L×NA/mol=0.002NA,
将此10ml溶液稀释至1L,则Na+的浓度为$\frac{0.2mol/L}{100}$=0.002mol/L,所含Na+个数不变,为0.002NA,
故答案为:0.2mol/L;0.002NA;0.002mol/L;0.002NA.
点评 本题考查物质的量浓度的计算以及一定物质的量浓度溶液的配制,侧重于学生的分析、计算能力的考查,明确配制原理和过程是解题关键,注意误差分析的方法.

| A. | 物质的量浓度相等的碳酸氢钡溶液和氢氧化钠溶液等体积混合Ba2++2HCO3-+2OH-=BaCO3↓+CO32-+2H2O | |
| B. | NaHSO4溶液中滴加入Ba(OH)2溶液至中性:2H++Ba2++2OH-+SO42-=BaSO4↓+2H2O | |
| C. | 以石墨作电极电解氯化镁溶液:2Cl-+2H2O═2OH-+H2↑+Cl2↑ | |
| D. | 碳酸氢钠溶液加入氯化铝溶液 3HCO3-+Al3+?3CO2↑+Al(OH)3↓ |
(1)配制0.1mol/L的盐酸溶液
| 量筒量取浓盐酸体积/mL | 应选用量筒的规格(可供选择的规格10mL、25mL、50mL) | 应选用容量瓶的规格(可供选择的规格100mL、250mL、500mL) | 除容量瓶外还需要的其它仪器 |
| ①2.1mL | ②25 mL | ③250 mL | ④烧杯、玻璃棒、胶头滴管、量筒 |
A、用30mL水洗涤烧杯内壁和玻璃棒2-3次,洗涤液均注入容量瓶,振荡
B、用量筒准确量取所需的浓盐酸的体积,将量好的浓盐酸倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C、将已冷却的盐酸沿玻璃棒注入容量瓶中
D、将容量瓶盖紧,振荡,摇匀
E、继续往容量瓶内小心加水,直到溶液凹面恰好与刻度相切
(3)指出本实验的操作错误的地方,并进行更正.E,继续往容量瓶内小心加水到溶液离刻度线1~2 cm处,改用胶头滴管滴加水至凹液面恰好与刻度线相切.
(4)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”):
①所用的浓盐酸长时间放置在密封不好的容器中偏低;
②若加蒸馏水时不慎超过了刻度偏低;
③若定容时俯视刻度线偏高;
④用量筒量取浓盐酸时仰视偏高.
| A. | 氧化性:Cl2>Fe3+>I2 | B. | 氧化性:Fe3+>I2>Cl2 | ||
| C. | 还原性:I-<Fe2+<Cl- | D. | 还原性:Cl-<I-<Fe2+ |
 原子序数依次增大A、B、C、D、E、F(A、B、C、D、E、F分别代表元素符号)六种短周期元素.元素A的原子半径在短周期中最小,元素C的单质在空气中含量最多,D+比F-少一个电子层,E所在周期的各元素单质沸点变化如下图(元素按原子序数递增顺序连续排列),B、C两种元素分别能与A形成等电子的甲、乙两种分子,且两种分子中各原子的个数见下表:
原子序数依次增大A、B、C、D、E、F(A、B、C、D、E、F分别代表元素符号)六种短周期元素.元素A的原子半径在短周期中最小,元素C的单质在空气中含量最多,D+比F-少一个电子层,E所在周期的各元素单质沸点变化如下图(元素按原子序数递增顺序连续排列),B、C两种元素分别能与A形成等电子的甲、乙两种分子,且两种分子中各原子的个数见下表:| 化合物 | 甲 | 乙 |
| 原子个数比 | B:A=1:4 | C:A=1:3 |
(2)分子甲的空间构型为正四面体,该分子中B的原子轨道发生的是sp3杂化.
(3)E单质属于分子晶体,E与A元素形成极性分子(填“极性”或“非极性”)
(4)D在F中燃烧的产物属于离子晶体,其晶体中与D+最近且等距离的F-有6个.
(5)C元素的第一电离能(I1)>氧元素的第一电离能(I1)(填“<”或“>”或“=”).
| A. | SiO2中含Al2O3杂质,可以加入足量NaOH溶液然后过滤除去 | |
| B. | NH4Cl固体中混有少量的单质I2,可用加热方法将I2除去 | |
| C. | CO2中含有SO2杂质,可以通过盛有饱和Na2CO3溶液的洗气瓶除去 | |
| D. | NaHCO3溶液中含有Na2SiO3杂质,可以通入足量的CO2,然后过滤除去 |
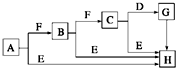 下面是有关物质的转化关系图(部分产物已省略),其中A为单质,E在常温下为液体,D是一种气体,C的相对分子质量为78.请回答下列有关问题:
下面是有关物质的转化关系图(部分产物已省略),其中A为单质,E在常温下为液体,D是一种气体,C的相对分子质量为78.请回答下列有关问题: ;G→H的化学方程式Na2CO3+Ca(OH)2═CaCO3↓+2NaOH.
;G→H的化学方程式Na2CO3+Ca(OH)2═CaCO3↓+2NaOH.