题目内容
【题目】(1)下列数据是对应物质的熔点(℃)
NaCl | Na2O | AlF3 | AlCl3 | BCl3 | Al2O3 | CO2 | SiO2 |
801 | 920 | 1291 | 190 | -109 | 2073 | -57 | 1723 |
据此作出的下列判断中,错误的是_____。
A 铝的化合物晶体中不存在离子晶体
B 表中只有BCl3、干冰是分子晶体
C 同族元素的氧化物可形成不同类型的晶体
D 不同族元素的氧化物可形成不同类型的晶体
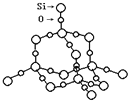
(2)SiO2晶体结构片断如图所示。SiO2晶体中Si原子数目和Si﹣O键数目的比例为_____。
通常人们把拆开1mol 某化学键所吸收的能量看成该化学键的键能。
化学键 | Si-O | Si-Si | O=O |
键能/KJmol-1 | 460 | 176 | 498 |
Si(s)+ O2(g)=SiO2(s),该反应的反应热△H=__________。
(3)单质铝晶体晶胞特征如图乙所示.则晶胞中铝原子的配位数为_____,晶胞中存在两种空隙,分别是___________、___________。

【答案】AB 1:4 -990 kJ/mol 12 正四面体空隙 正八面体空隙
【解析】
(1)A.由表中数据可知,AlF3、Al2O3为离子晶体,故A错误;
B.表中AlCl3、BCl3和干冰是分子晶体,沸点都较低,故B错误;
C.C和Si同主族,但氧化物的晶体类型不同,分别属于分子晶体和原子晶体,故C正确;
D.Na和Si不同主族,Na2O属于离子晶体,SiO2属于原子晶体,不同族元素的氧化物可形成不同类型的晶体,故D正确;
故答案为:AB;
(2) SiO2晶体中每个Si原子形成4个Si-O键,1mol SiO2晶体中含有4molSi-O键,则SiO2晶体中Si和Si-O键的比例为1:4,因晶体硅中每个Si原子与周围的4个硅原子形成正四面体,向空间延伸的立体网状结构,每Si原子与周围的4个Si原子形成4个Si-Si键,每个Si-Si键为1个Si原子提供![]() 个Si-Si键,所以1mol晶体硅中含有1mol×4×
个Si-Si键,所以1mol晶体硅中含有1mol×4×![]() =2molSi-Si键,反应热△H=反应物总键能-生成物总键能,所以Si(s)+O2(g)=SiO2(s)中,△H=176kJ/mol×2mol+498kJ/mol-460kJ/mol×4=-990 kJ/mol;
=2molSi-Si键,反应热△H=反应物总键能-生成物总键能,所以Si(s)+O2(g)=SiO2(s)中,△H=176kJ/mol×2mol+498kJ/mol-460kJ/mol×4=-990 kJ/mol;
(3)晶胞中距离最近的原子为位于定点和面心位置的两个原子,每个定点周围有3×![]() ×8=12个原子,即配位数为12;观察晶胞结构可知晶胞中存在两种空隙,分别是正四面体空隙、正八面体空隙。
×8=12个原子,即配位数为12;观察晶胞结构可知晶胞中存在两种空隙,分别是正四面体空隙、正八面体空隙。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】部分中学化学常见元素原子结构及性质如表所示:
序号 | 元素 | 结构及性质 |
A | A单质是生活中常见金属,它有两种氯化物,相对分子质量相差35.5 | |
B | B原子最外层电子数是内层电子总数的1/5 | |
③ | C | C是常见化肥的主要元素,单质常温下呈气态 |
④ | D | D单质被誉为“信息革命的催化剂”,是常用的半导体材料 |
① | E | 通常情况下,E没有正化合价,A、B、C、D、F都能与E形成化合物 |
② | F | F在周期表中可以排在ⅠA族,也有人提出排在ⅦA族 |
(1)A元素在周期表中的位置为____________________________________________。
(2)B与C形成的化合物的化学式为________,它属于________(填“离子”或“共价”)化合物。
(3)①F与E可以形成原子个数比分别为2∶1、1∶1的两种化合物X和Y,区别X与Y的水溶液的实验方法是____________________
②F与C组成的两种化合物M和N所含的电子数分别与X、Y相等,则M的水溶液显________性,N的结构式为________。
(4)C与E都是较活泼的非金属元素,用化学方程式表明这两种单质的氧化性强弱____。
(5)有人认为B、D的单质用导线连接后插入氯化钠溶液中可以形成原电池,你认为是否可以,若可以,试写出正极的电极方程式(若认为不行可不写)___________________