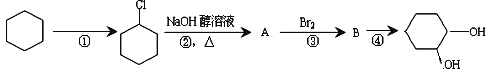
题目内容
【题目】清洁能源的开发、废水的处理都能体现化学学科的应用价值。
Ⅰ. 工业上可利用CO2来制备清洁燃料甲醇,有关化学反应如下:
反应A:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-49.6kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.6kJ·mol-1
反应B:CO2(g)+H2![]() H2O(g)+CO(g) △H2=+41kJ·mol-1
H2O(g)+CO(g) △H2=+41kJ·mol-1
(1)写出用CO(g)和H2(g)合成CH3OH(g)反应的热化学方程式: _____________________________。
(2)写出两个有利于提高反应A中甲醇平衡产率的条件_______________________。
(3)在Cu-ZnO/ZrO2催化下,CO2和H2混和气体,体积比1∶3,总物质的量amol进行反应,测得CO2转化率、CH3OH和CO选择性随温度、压强变化情况分别如图所示(选择性:转化的CO2中生成CH3OH或CO的百分比)。

温度对反应的影响 压强对反应的影响
由以上两图可知,影响产物选择性的外界条件是______。
A. 温度 B. 压强 C. 催化剂
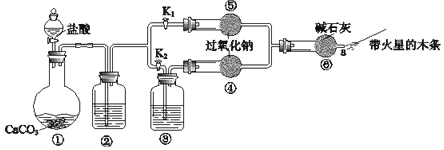
Ⅱ.实验室模拟“间接电化学氧化法”处理氨氮废水中NH4+的装置如图所示。以硫酸铵和去离子水配制成初始的模拟废水,并以NaCl调节溶液中氯离子浓度,阳极产物将氨氮废水中的NH4+氧化成空气中的主要成分。

(4)阳极反应式为__________________________________。
(5)除去NH4+的离子反应方程式为________________________________________。
Ⅲ.电化学降解法可用于治理水中硝酸盐的污染。电化学降解NO3-的原理如图所示:

(6)A为_______极,若电解过程中转移1 mol 电子,则膜来两侧电解质溶液的质量变化差(Δm左 -Δm右)为________。
【答案】CO(g)+2H2(g)=CH3OH(g) △H=-90.6kJ·mol-1 增大压强,适当降温,及时分离出产物(H2O或CH3OH) AB 2Cl--2e―= Cl2↑ 2NH4++3Cl2=8H++N2↑+6Cl― 正 7.2g
【解析】
(1)根据盖斯定律分析计算△H;
(2)提高甲醇的产率,应使平衡正向移动,该反应为气体体积缩小的放热反应,结合平衡移动原理分析;
(3)根据图1、图2曲线变化分析;
(4)阳极发生氧化反应,据此分析解答;
(5)氯气具有氧化性,而铵根离子中氮是-3价,被氧化成氮气,据此书写反应的离子方程式;
(6)由图示知,在Ag-Pt电极上发生NO3-生成N2的反应,结合电解原理分析判断;首先书写电极反应式,结合电极反应式计算阳极产生的气体质量和进入阴极室的H+质量,确定阳极室质量的减少量;阴极室中放出N2,同时有H+进入阴极室,判断阴极室质量的减少量,由此计算膜两侧电解液的质量差。
(1)①CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H1=-49.6kJmol-1,②CO2(g)+H2H2O(g)+CO(g)△H2=+41kJmol-1,根据盖斯定律,①-②可得:CO(g)+2H2(g)=CH3OH(g)△H=(-49.6kJmol-1)-(+41kJmol-1)=-90.6kJmol-1,故答案为:CO(g)+2H2(g)=CH3OH(g)△H=-90.6kJmol-1 ;
(2)反应CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H1=-49.6kJmol-1,为气体体积缩小的放热反应,增大压强、降低温度或及时分离出产物,都可以使平衡正向移动,从而提高甲醇的平衡产率,故答案为:增大压强,适当降温(或及时分离出产物);
(3)催化剂不影响平衡,则不影响产物的选择性,根据图1、图2可知,温度和压强会影响产物选择性,故答案为:AB;
(4)阳极发生氧化反应,阳极上氯离子放电生成氯气,电极反应式为:2Cl--2e-=Cl2↑,故答案为:2Cl--2e-=Cl2↑;
(5)氯气具有氧化性,而铵根离子中氮是-3价,能够被氧化成氮气,氯气得电子生成-1价的氯离子,反应的离子方程式为:2NH4++3Cl2=8H++N2↑+6Cl-,故答案为:2NH4++3Cl2=8H++N2↑+6Cl-;
(6)由图示知,在Ag-Pt电极上NO3-生成N2,发生的是还原反应,阴极上发生的电极反应式为:2NO3-+12H++10e-═N2↑+6H2O,因此Ag-Pt电极为阴极,则B为直流电源的负极,A为电源正极;电解过程中转移1mol电子时,阳极的电极反应式为2H2O-4e-=O2↑+4H+,阳极产生O28 g,并产生1g H+进入阴极室,阳极室质量减少9 g,阴极室中放出0.1 mol N2,质量减少2.8g,同时有1mol H+进入阴极室,阴极室质量共减少1.8g,膜两侧电解液的质量变化差值(△m左-△m右)为9g-1.8g=7.2 g,故答案为:正;7.2g。

【题目】实验室以苯甲醛为原料制备间溴苯甲醛的反应如下:
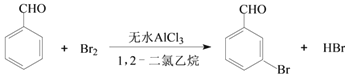
已知:(1)间溴苯甲醛温度过高时易被氧化。
(2)溴、苯甲醛、1,2-二氯乙烷、间溴苯甲醛的沸点及相对分子质量见下表:
物质 | 溴 | 苯甲醛 | 1,2-二氯乙烷 | 间溴苯甲醛 |
沸点/℃ | 58.8 | 179 | 83.5 | 229 |
相对分子质量 | 160 | 106 | 185 |
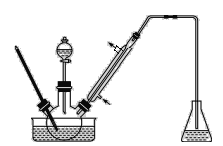
步骤1:将一定配比的无水AlCl3、1,2-二氯乙烷和苯甲醛充分混合后装入三颈烧瓶(如图所示),缓慢滴加经浓硫酸干燥过的足量液溴,控温反应一段时间,冷却。
步骤2:将反应混合物缓慢加入一定量的稀盐酸中,搅拌、静置、分液。有机层用10% NaHCO3溶液洗涤。
步骤3:经洗涤的有机层加入适量无水MgSO4固体,放置一段时间后过滤出MgSO4nH2O晶体。
步骤4:减压蒸馏有机层,收集相应馏分。
(1)实验装置中冷凝管的主要作用是_________,锥形瓶中应为_____(填化学式)溶液。
(2)步骤1反应过程中,为提高原料利用率,适宜的温度范围为(填序号)_______。
A.>229℃ B.58.8℃~179℃ C.<58.8℃
(3)步骤2中用10% NaHCO3溶液洗涤,是为了除去溶于有机层的_______(填化学式)。
(4)步骤3中加入无水MgSO4固体的作用是_____________。
(5)步骤4中采用减压蒸馏,是为了防止__________________________________。
(6)若实验中加入了5.3 g苯甲醛,得到3.7 g间溴苯甲醛。则间溴苯甲醛产率为______。
【题目】肌红蛋白(Mb)可与O2结合生成MbO2:![]() 。37℃时测得肌红蛋白的结合度(α)与p(O2)的关系如下表。
。37℃时测得肌红蛋白的结合度(α)与p(O2)的关系如下表。
已知:K=![]()
[结合度(α)指已与O2结合的肌红蛋白占总肌红蛋白的物质的量分数]
p(O2)/kPa | 0.50 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 | 6.00 |
α(MbO2)% | 50.0 | 66.7 | 80.0 | 85.7 | 88.9 | 90.9 | 92.3 |
(1) 37℃时,若空气中氧气分压为21.0 kPa,则人正常呼吸时α的最大值为________%(保留1位小数)。
(2) 温度不变时,游客在山顶时体内MbO2的浓度比在山下________(填“高”或“低”)。
(3) 研究发现,v正=k正·c(Mb)·p(O2),v逆=k逆·c(MbO2)。已知37℃时k逆=60 s-1,则k正=_________(注明速率常数单位)。