题目内容
【题目】mg气体A和ng气体B的分子数相等,下列说法不正确的是( )
A.同体积的气体A和气体B的质量比为m:n
B.25℃时,1kg气体A和1kg气体B的分子数比为n: m
C.同温同压时气体A和气体B的密度比为n:m
D.标况时,等质量的A和B气体的体积比为n:m
【答案】D
【解析】
m g气体A和n g气体B所含分子数相等,则物质的量相等,二者的,摩尔质量之比为m:n
A.因气体存在的条件未知,不一定为相同条件下,则不能确定同体积的质量关系,故A错误;
B.由![]() 可知,相同质量时气体的分子数之比与摩尔质量呈反比,则相同质量的气体A和气体B的分子数之比为n:m,故B错误;
可知,相同质量时气体的分子数之比与摩尔质量呈反比,则相同质量的气体A和气体B的分子数之比为n:m,故B错误;
C.结合![]() 可知,同温、同压下,气体A和气体B的密度之比为m:n,故C错误;
可知,同温、同压下,气体A和气体B的密度之比为m:n,故C错误;
D.由![]() 可知,相同质量的气体A和气体B的体积之比与摩尔质量呈反比,为n:m,故D正确
可知,相同质量的气体A和气体B的体积之比与摩尔质量呈反比,为n:m,故D正确

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】已知25 ℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | Ka=1.8×10-5 |
| Ka=3.0×10-8 |
(1)物质的量浓度均为0.1 mol·L-1的下列四种溶液,pH由小到大排列的顺序是__________(用编号填写)。
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
(2)常温下,0.1 mol·L-1 CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是__________(填字母)。
a. ![]() b.
b. ![]() c.
c. ![]()
d. ![]() e.
e. ![]()
(3)写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式__________。
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中:c(CH3COO-)-c(Na+)=__________(填准确数值)。
(5)25℃时,将a mol·L-1的醋酸与b mol·L-1氢氧化钠等体积混合,反应后溶液恰好显中性,用a、b表示醋酸的电离常数为__________
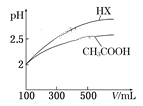
(6)体积均为100 mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数__________(填“>”、”=”或“<”)CH3COOH的电离平衡常数。
【题目】(1)一定温度下,在恒容密闭容器中NO2与O2反应为4NO2(g)+O2(g)![]() 2N2O5(g)。(不考虑NO2的分解 ) 若已知该反应是放热反应,则K550℃___K350℃,(填“大于” “等于”或“小于”)。反应达平衡后,若再通入一定量NO2,则平衡常数K将_______,NO2的转化率______。(填“增大”“减小”或“不变”)
2N2O5(g)。(不考虑NO2的分解 ) 若已知该反应是放热反应,则K550℃___K350℃,(填“大于” “等于”或“小于”)。反应达平衡后,若再通入一定量NO2,则平衡常数K将_______,NO2的转化率______。(填“增大”“减小”或“不变”)
(2)若初始时在恒容密闭容器中加入N2O5,下表为N2O5分解反应在一定温度下不同时间测得N2O5浓度的部分实验数据:
t/s | 0 | 500 | 1000 |
c(N2O5) mol/L | 5.00 | 3.25 | 2.48 |
①写出该反应的平衡常数表达式:K=____________。
②1000s内N2O5的分解速率为:_____________。
③若每有1 mol N2O5分解,吸收Q kJ的热量,写出该分解反应的热化学方程式____。
④能使4NO2(g)+O2(g)![]() 2N2O5(g)反应速率增大,且平衡向正反应方向移动的是(_______)
2N2O5(g)反应速率增大,且平衡向正反应方向移动的是(_______)
a.及时分离出N2O5 b.适当提高温度 c.增大O2浓度 d.选择高效催化剂