题目内容
【题目】依据有关信息解答下列化学实验问题:
(Ⅰ)醛类是重要的工业原料,可以跟亚硫酸氢钠饱和溶液反应,生成物是α﹣羟基磺酸钠(易溶于水,不溶于饱和亚硫酸氢钠溶液)R-CHO+NaHSO3![]() R-CH(OH)-SO3Na
R-CH(OH)-SO3Na
(1)上述反应类型为________反应。若使CH3 CH(OH)-SO3Na全部变成乙醛,可采用的试剂是__________或__________;分离乙醛的操作方法 _____________。
(Ⅱ)实验室利用苯甲醛(安息香醛)制备苯甲醇和苯甲酸的化学原理:
![]() (此原理适用于无α-氢的醛)
(此原理适用于无α-氢的醛)
已知部分物质的性质:
苯甲醇:熔点(℃):-15.3℃,稍溶于水,易溶于有机溶剂;
苯甲醛:熔点(℃):-26℃,微溶于水,易溶于有机溶剂;
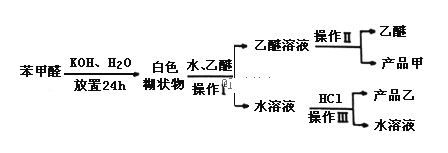
苯甲酸:溶解度为0.344g(25℃),易溶于有机溶剂.主要过程如图所示:
回答下列问题:
(2)操作Ⅰ的名称是___________,乙醚溶液中所溶解的主要成分是__________;
(3)操作Ⅲ的名称是________,产品乙是_______________.
(4)按上述操作所得的产品甲中常含有一定量的有机杂质___________(填写杂质的名称);限用下列试剂:酸性KMnO4、稀NaOH溶液、稀H2SO4、饱和NaHSO3溶液.写出检验产品甲中含有该杂质的过程:______________________________.
【答案】.加成NaOHHCl蒸馏萃取分液苯甲醇过滤苯甲酸苯甲醛取少量产品甲于试管中,向试管中滴加适量的饱和NaHSO3溶液,如果有晶体析出,说明含有苯甲醛
【解析】
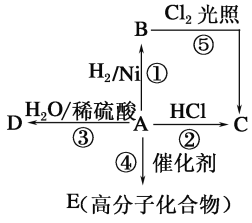
Ⅰ、(1)R-CHO+NaHSO3![]() R-CH(OH)-SO3Na反应类型为加成反应,根据可逆反应R-CHO+NaHSO3R-CH(OH)-SO3Na,要想使R-CH(OH)-SO3Na全部变成乙醛即使平衡向逆反应方向移动,可以采取加入氢氧化钠或者盐酸消耗亚硫酸钠使平衡逆向移动;分离互溶的有机物采用蒸馏的方法;
R-CH(OH)-SO3Na反应类型为加成反应,根据可逆反应R-CHO+NaHSO3R-CH(OH)-SO3Na,要想使R-CH(OH)-SO3Na全部变成乙醛即使平衡向逆反应方向移动,可以采取加入氢氧化钠或者盐酸消耗亚硫酸钠使平衡逆向移动;分离互溶的有机物采用蒸馏的方法;
Ⅱ、由流程可知,苯甲醛与KOH反应生成苯甲醇、苯甲酸钾,然后加水、乙醚萃取苯甲醇,操作Ⅰ分层乙醚与水溶液,则为萃取分液,则乙醚溶液中含苯甲醇,操作II为蒸馏,得到产品甲为苯甲醇;水溶液中含苯甲酸钾,加盐酸发生强酸制取弱酸的反应,生成苯甲酸,苯甲酸的溶解度小,则操作Ⅲ为过滤,则产品乙为苯甲酸,以此来解答。
Ⅰ、(1)R-CHO+NaHSO3![]() R-CH(OH)-SO3Na反应类型为加成反应;因为可逆反应R﹣CHO+NaHSO3R﹣CH(OH)﹣SO3Na,要想使CH3CH(OH)﹣SO3Na全部变成乙醛即使平衡向逆反应方向移动,可以采取加入氢氧化钠或者盐酸消耗亚硫酸钠使平衡逆向移动,所以可以加入的为NaOH或者HCl;分离互溶的有机物采用蒸馏的方法,所以分离乙醛的操作方法为蒸馏,
R-CH(OH)-SO3Na反应类型为加成反应;因为可逆反应R﹣CHO+NaHSO3R﹣CH(OH)﹣SO3Na,要想使CH3CH(OH)﹣SO3Na全部变成乙醛即使平衡向逆反应方向移动,可以采取加入氢氧化钠或者盐酸消耗亚硫酸钠使平衡逆向移动,所以可以加入的为NaOH或者HCl;分离互溶的有机物采用蒸馏的方法,所以分离乙醛的操作方法为蒸馏,
故答案为:加成;NaOH或HCl;蒸馏;
Ⅱ、由流程可知,苯甲醛与KOH反应生成苯甲醇、苯甲酸钾,然后加水、乙醚萃取苯甲醇,操作Ⅰ分层乙醚与水溶液,则为萃取分液,则乙醚溶液中含苯甲醇,操作II为蒸馏,得到产品甲为苯甲醇;水溶液中含苯甲酸钾,加盐酸发生强酸制取弱酸的反应,生成苯甲酸,苯甲酸的溶解度小,则操作Ⅲ为过滤,则产品乙为苯甲酸;
(2)根据以上分析,操作Ⅰ分层乙醚与水溶液,则为萃取分液,故答案为:萃取分液;苯甲醇;
(3)根据以上分析,操作Ⅲ为过滤,产品乙是苯甲酸,故答案为:过滤;苯甲酸;
(4)根据苯甲醛与KOH反应生成苯甲醇、苯甲酸钾,所得混合物中可能还有未反应的苯甲醛,然后加水、乙醚萃取苯甲醇和未反应的苯甲醛,则乙醚溶液中含苯甲醇和未反应的苯甲醛,所以操作II为蒸馏,得到产品甲为苯甲醇和未反应的苯甲醛,根据醛类是重要的工业原料,可以跟亚硫酸氢钠饱和溶液发生加成反应,生成是α﹣羟基磺酸钠(易溶于水,不溶于饱和亚硫酸氢钠溶液),所以可以通过取少量产品甲于试管中,向试管中滴加适量的饱和NaHSO3溶液,如果有晶体析出,说明含有苯甲醛,
故答案为:苯甲醛;取少量产品甲于试管中,向试管中滴加适量的饱和NaHSO3溶液,如果有晶体析出,说明含有苯甲醛。

【题目】利用铜萃取剂M,通过如下反应实现铜离子的富集:
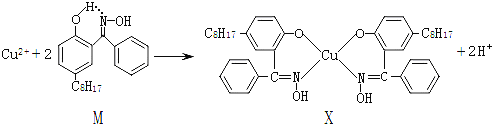
(1)关于M所含元素的说法正确的是______________。
A.电负性由大到小顺序:O>N>C>H
B.第一电离能由大到小的顺序:O>N>C
C.氮原子以sp2杂化轨道与氧原子形成σ键
D.从物质分类角度M属于芳香烃,M中所有的碳原子不可能共面
E.组成M元素的氢化物稳定性:CH4<H2O<NH3
(2)上述反应中断裂和生成的化学键有_______(填序号)。
A.氢键 B.配位键 C.金属键 D.范德华力 E.共价键 F.离子键
(3)M与W(分子结构如上图)相比,M的水溶性小,更利于Cu2+的萃取。M水溶性小的主要原因是_______________。
(4)基态Cu2+的外围电子排布图为________________,Cu2+等过渡元素水合离子是否有颜色与原子结构有关,且存在一定的规律。判断Sc3+、Zn2+的水合离子为无色的依据是_____________________________________________________________。
离子 | Sc3+ | Ti3+ | Fe2+ | Cu2+ | Zn2+ |
颜色 | 无色 | 紫红色 | 浅绿色 | 蓝色 | 无色 |
(5)已知:Y原子最高价氧化物对应水化物的酸性最强。铜与Y形成化合物的晶胞如附图所示(黑点代表铜原子,空心圆代表Y原子)。
①该晶体的化学式为_______________。(用元素符号表示)
②已知铜和Y原子的电负性分别为1.9和3.0,则铜与Y原子形成的化合物属于____________(填“离子”或“共价”)化合物。
③已知该晶体的密度为ρg·cm-3,阿伏加德罗常数为NA,则该晶体中铜原子与Y原子之间的最短距离为_______________pm(只写计算式)。