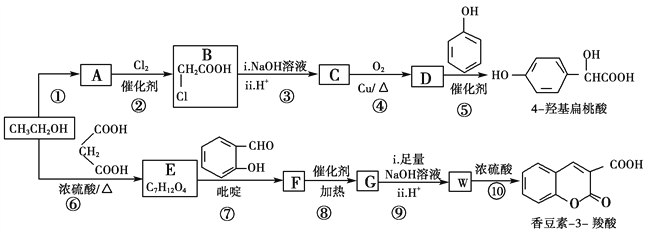
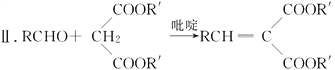
题目内容
【题目】下列解释事实的方程式不正确的是
A. 测0.1mol/L氨水的pH为11:NH3·H2O![]() NH
NH![]() +OH-
+OH-
B. 用Na2CO3处理水垢中CaSO4:CaSO4(s)+CO![]() (aq)
(aq)![]() SO
SO![]() (aq)+CaCO3(s)
(aq)+CaCO3(s)
C. 用CuCl2溶液做导电实验,灯泡发光:CuCl2![]() Cu2++2Cl-
Cu2++2Cl-
D. 使用碱性电解质的氢氧燃料电池的正极反应式:O2+2H2O+4e-=4OH-
【答案】C
【解析】A.测0.1 mol/L氨水的pH为11,溶液显示碱性,原因是一水合氨为弱碱,溶液中部分电离出铵根离子和氢氧根离子,其电离方程式为:NH3H2ONH4++OH-,选项A正确;B.碳酸钙溶解度比硫酸钙小,用Na2CO3溶液处理水垢中含有的CaSO4,生成疏松的碳酸钙,易于处理,选项B正确;C.用CuCl2溶液做导电实验,灯泡发光,氯化铜为强电解质,溶液中完全电离出铜离子和氯离子,电离过程不需要通电,氯化铜的电离方程式为CuCl2=Cu2++2Cl-,选项C不正确;D.通入氧气的电极为正极,正极上氧气得电子发生还原反应,电极反应式为:O2+2H2O+4e-=4OH-,选项D正确。答案选C。

练习册系列答案
相关题目