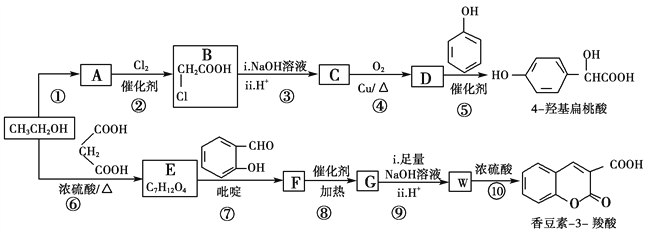
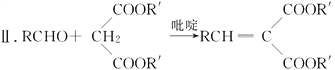
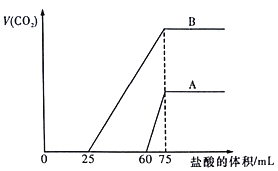
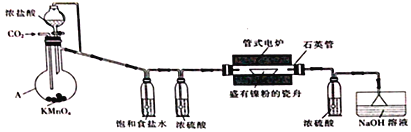
题目内容
【题目】金属铝用途广泛,工业上利用铝矾土矿(主要成分是Al2O3)制备金属铝。
(1)首先获得纯净的Al2O3,其工艺流程如下:
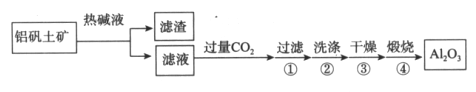
①滤液中通入过量CO2的反应离子方程式是________________。
②煅烧生成氧化铝的化学方程式是______________。
(2)将Al2O3溶解于熔融的冰晶石(助熔剂)中,以石墨衬里为阴极,石墨棒为阳极,进行电解。
①电解Al2O3能制备金属铝的原因是__________(填序号)。
a. Al2O3属于电解质
b. Al2O3属于离子化合物
c. Al2O3属于两性氧化物
d. Al2O3在熔融状态时能导电
②Al单质在_________极产生。
③阳极石墨棒需要不断补充,结合电极反应式,简述其原因是________________。
【答案】 AlO![]() +CO2+2H2O=HCO
+CO2+2H2O=HCO![]() +Al(OH)3↓ 2Al(OH)3
+Al(OH)3↓ 2Al(OH)3![]() Al2O3+3H2O abd 阴 阳极反应式是2O2--4e-=O2↑,高温条件下,生成的氧气与石墨反应,消耗阳极材料,所以需要补充
Al2O3+3H2O abd 阴 阳极反应式是2O2--4e-=O2↑,高温条件下,生成的氧气与石墨反应,消耗阳极材料,所以需要补充
【解析】(1)①铝矾土矿(主要成分是Al2O3)与热碱溶反应后滤液主要成分为偏铝酸盐,通入过量CO2的反应生成氢氧化铝和碳酸氢盐,反应的离子方程式为![]() +CO2+2H2O=
+CO2+2H2O=![]() +Al(OH)3↓;②煅烧生成氧化铝的化学方程式是2Al(OH)3
+Al(OH)3↓;②煅烧生成氧化铝的化学方程式是2Al(OH)3![]() Al2O3+3H2O;(2)①电解Al2O3能制备金属铝的原因是Al2O3属于离子化合物,属于电解质,在熔融状态时能导电;答案选abd;②铝离子在阴极得电子产生Al单质;③阳极反应式是2O2--4e-=O2↑,高温条件下,生成的氧气与石墨反应,消耗阳极材料,所以需要补充。
Al2O3+3H2O;(2)①电解Al2O3能制备金属铝的原因是Al2O3属于离子化合物,属于电解质,在熔融状态时能导电;答案选abd;②铝离子在阴极得电子产生Al单质;③阳极反应式是2O2--4e-=O2↑,高温条件下,生成的氧气与石墨反应,消耗阳极材料,所以需要补充。

练习册系列答案
 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案
相关题目