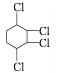
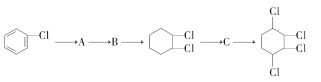
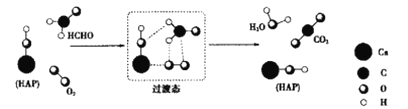
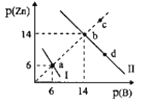
��Ŀ����
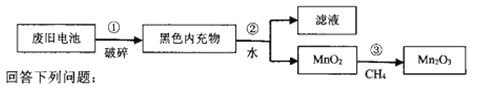
����Ŀ�����������̣�Mn2O3����������֯��ҵ��ӡȾ����Ϊ���������Դ��̽���Ͼɸɵ�صı��Ϊ������ʵ�������÷Ͼɸɵ���е�MnO2�Ʊ�Mn2O3��������ͼ��
��l������ڼ�ˮ��IJ�������Ҫ�IJ����������ձ����__�����ţ���
A�������� B����Һ©�� C����ͨ©�� D���ƾ���
��2���������ͼ�еļ�װ����������CH4����ԭMnO2�Ʊ�Mn2O3��
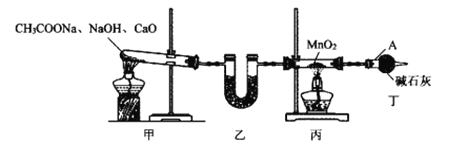
������A������Ϊ__��װ������ʢ�е��Լ�������__�����ţ���
a��Ũ���� b����ʯ�� c������ d������������
��ʵ��������ȵ�ȼ__�����������������������ľƾ��ƣ���ȼ�����ƾ���ǰ����еIJ�����___��
�۲ⶨװ�ñ�����������CO��CO2���ʵ���Ϊ1��1����÷�Ӧ�Ļ�ѧ����ʽΪ__��
�ܸ�װ�ô��ڵ�ȱ��Ϊ__��
��3��ʵ�������������ȴ��ȡװ�ñ��ڴֲ�ƷΪ7.19g��ʹ֮�����������ữ��KI��Һ��Ӧ���ֲ�Ʒ�е�Mn2O3��MnO2����Ԫ�ؾ�ת��ΪMn2+�������û��Һϡ����500mL��Ȼ��ȡ25.00mLϡ�ͺ����Һ����0.200molL-1��Na2S2O3������Һ�ζ����ﵽ�ζ��յ�ʱ������Na2S2O3����ҺΪ25.00mL������֪��I2+2Na2S2O3�TNa2S4O6+2NaI��
�ٸõζ������п���ѡ��__��ָʾ����
�����ζ�ǰ�ζ����������ݣ��ﵽ�ζ��յ�ʱ�����촦�����ݣ���ⶨ�ı�Һ�����__������ƫ��������ƫС��������Ӱ��������
�۴ֲ�Ʒ��Mn2O3�Ĵ���Ϊ__%��������С�����1λ��
���𰸡�C ���θ���� bd �� �������Ĵ��� 2CH4+14MnO2![]() 7Mn2O3+CO+CO2+4H2O ȱ��CO��β������ ���� ƫС 87.9
7Mn2O3+CO+CO2+4H2O ȱ��CO��β������ ���� ƫС 87.9
��������
�÷Ͼɸɵ���е�MnO2�Ʊ�Mn2O3�������̿�֪���ٷ�������ܽ���˷����MnO2������CH4��ԭMnO2�Ʊ�Mn2O3����ӦΪ2CH4+14MnO2![]() 7Mn2O3+CO+CO2+4H2O���Դ˽��1������2����
7Mn2O3+CO+CO2+4H2O���Դ˽��1������2����
(3)����Mn2O3+2I-+6H+=2Mn2++I2+3H2O��MnO2+2I-+4H+=Mn2++I2+2H2O��I2+2Na2S2O3�TNa2S4O6+2NaI���ҵ�������������Դ������
(l)����ڼ�ˮ��IJ���Ϊ���ˣ���Ҫ�IJ����������ձ������ͨ©����
(2)������A������Ϊ���θ���ܣ�װ������ʢ�е��Լ������Ǽ�ʯ�һ����������ף��ɸ���������壻
�����鲻������������ը����ʵ��������ȵ�ȼ�״��ľƾ��ƣ���ȼ�����ƾ���ǰ����еIJ����Ǽ������Ĵ��ȣ�
���ⶨװ�ñ�����������CO��CO2���ʵ���Ϊ1��1����÷�Ӧ�Ļ�ѧ����ʽΪ2CH4+14MnO2![]() 7Mn2O3+CO+CO2+4H2O��
7Mn2O3+CO+CO2+4H2O��
����װ�ô��ڵ�ȱ��Ϊȱ��CO��β��������
(3)�ٸõζ������п���ѡ�õ�����ָʾ����
�����ζ�ǰ�ζ����������ݣ��ﵽ�ζ��յ�ʱ�����촦�����ݣ����ı���Һ�����ȡƫС������I2+2Na2S2O3�TNa2S4O6+2NaI��֪���ɵ�Ϊ0.025L��0.2mol/L��![]() =0.05mol����7.19g������Mn2O3���ʵ���Ϊx��MnO2���ʵ���Ϊy����Mn2O3+2I-+6H+=2Mn2++I2+3H2O��MnO2+2I-+4H+=Mn2++I2+2H2O����֪
=0.05mol����7.19g������Mn2O3���ʵ���Ϊx��MnO2���ʵ���Ϊy����Mn2O3+2I-+6H+=2Mn2++I2+3H2O��MnO2+2I-+4H+=Mn2++I2+2H2O����֪![]() �����x=0.04mol��y=0.01mol����ֲ�Ʒ��Mn2O3�Ĵ���Ϊ
�����x=0.04mol��y=0.01mol����ֲ�Ʒ��Mn2O3�Ĵ���Ϊ![]() ��100%=87.9%��
��100%=87.9%��

 ��У����ϵ�д�
��У����ϵ�д�