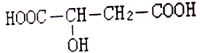题目内容
【题目】(1)材料是人类赖以生存的物质基础。
①制造水泥、玻璃都要用到的原料是___(填字母)。
a.石灰石 b.纯碱 c.黏土
②不锈钢丝与棉纤维可织成一种防辐射布料。这种布料属于___(填字母)。
a.合金材料 b.复合材料 c.陶瓷材料
③橡胶可用于制造轮胎,天然橡胶通过___(填字母)措施可增大强度和弹性。
a.硝化 b.氧化 c.硫化
(2)环境保护功在当代、利在千秋。
①燃煤中加入碳酸钙,可减少SO2的排放。表示该反应原理的化学方程式为___。
②治理废水中的重金属污染物可用沉淀法。往含铬(Cr3+)废水中加入石灰乳使Cr3+转变为___(填化学式)沉淀而除去。
③将CO2和H2按物质的量1∶4混合,在Ru/TiO2作催化剂、加热条件下反应可获得CH4。写出该反应的化学方程式:___。
(3)合理选择饮食,有益身体健康。某同学在食堂的午餐是:米饭、红烧肉、西红柿炒鸡蛋和一只苹果。
①其中主要为人体提供能量的食物是___。该食物中的主要成分在人体内完全水解的化学方程式为___。
②西红柿中富含维生素C,西红柿生吃比炒熟后吃维生素C的利用率高,原因是___。用淀粉溶液和碘水检验维生素C的还原性,有关实验操作和现象是___。
③苹果中含有一定量的铁元素,人体缺铁会导致的疾病是___。
【答案】a b c 2CaCO3+2SO2+O2![]() 2CaSO4+2CO2 Cr(OH)3 CO2+4H2
2CaSO4+2CO2 Cr(OH)3 CO2+4H2![]() CH4+2H2O 米饭 (C6H10O5)n(淀粉)+nH2O
CH4+2H2O 米饭 (C6H10O5)n(淀粉)+nH2O![]() nC6H12O6(葡萄糖) 高温会破坏维生素C 取2 mL淀粉溶液于试管中,滴入2滴碘水振荡,溶液变蓝,再滴入维生素C溶液,蓝色褪去 贫血
nC6H12O6(葡萄糖) 高温会破坏维生素C 取2 mL淀粉溶液于试管中,滴入2滴碘水振荡,溶液变蓝,再滴入维生素C溶液,蓝色褪去 贫血
【解析】
(1)①工业制备玻璃是利用二氧化硅、石灰石、纯碱高温加热反应生成,水泥制备利用粘土和石灰石高温加热制备,制造普通玻璃和水泥都需要用到的原料是石灰石;故答案为:石灰石;②防辐射布料是由不锈钢丝与棉纤维复合而成,属于复合材料,故答案为:b;③橡胶是制造轮胎的重要原料,天然橡胶通过硫化处理,使它的分子转化为体型结构,从而增大橡胶的强度,故答案为c;
(2)①燃煤中加入碳酸钙,可减少SO2的排放。表示该反应原理是碳酸钙和二氧化硫在氧气的参与下,反应生成硫酸钙和二氧化碳,方程式为:2CaCO3+2SO2+O2![]() 2CaSO4+2CO2;②往含铬(Cr3+)废水中加入石灰乳使Cr3+转变为Cr(OH)3沉淀而除去,故答案为:Cr(OH)3;③将CO2和H2按物质的量1∶4混合,方程式中CO2和H2的系数比是1∶4,产物是CH4和水,方程式为:CO2+4H2
2CaSO4+2CO2;②往含铬(Cr3+)废水中加入石灰乳使Cr3+转变为Cr(OH)3沉淀而除去,故答案为:Cr(OH)3;③将CO2和H2按物质的量1∶4混合,方程式中CO2和H2的系数比是1∶4,产物是CH4和水,方程式为:CO2+4H2![]() CH4+2H2O,正确答案是:CO2+4H2
CH4+2H2O,正确答案是:CO2+4H2![]() CH4+2H2O;
CH4+2H2O;
(3)①主要为人体提供能量的物质是糖类,米饭中含有大量的糖类——淀粉,故正确答案是:米饭;淀粉水解的方程式为:(C6H10O5)n(淀粉)+nH2O![]() nC6H12O6(葡萄糖),故答案为:(C6H10O5)n(淀粉)+nH2O
nC6H12O6(葡萄糖),故答案为:(C6H10O5)n(淀粉)+nH2O![]() nC6H12O6(葡萄糖);②维生素C不稳定,受热易分解,西红柿生吃比炒熟后吃维生素C的利用率高,原因是高温会破坏维生素C;用淀粉溶液和碘水检验维生素C的还原性,维生素C会把碘单质还原成碘离子,使原来的蓝色褪去,有关实验操作和现象是取2 mL淀粉溶液于试管中,滴入2滴碘水振荡,溶液变蓝,再滴入维生素C溶液,蓝色褪去;
nC6H12O6(葡萄糖);②维生素C不稳定,受热易分解,西红柿生吃比炒熟后吃维生素C的利用率高,原因是高温会破坏维生素C;用淀粉溶液和碘水检验维生素C的还原性,维生素C会把碘单质还原成碘离子,使原来的蓝色褪去,有关实验操作和现象是取2 mL淀粉溶液于试管中,滴入2滴碘水振荡,溶液变蓝,再滴入维生素C溶液,蓝色褪去;
(4)人体缺铁会导致的疾病是贫血,故答案是:贫血。

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案【题目】亚硝酸钠(NaNO2)是一种常见的食品添加剂,使用时必须严格控制其用量,某兴趣小组进行下面实验探究,查阅资料知道:
①2NO + Na2O2=2NaNO2
②2NO2+ Na2O2=2NaNO3
③酸性KMnO4溶液可将NO2-氧化为NO3-,MnO4-还原成Mn2+。
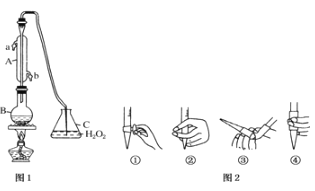
Ⅰ.产品制备与检验:用如下装置制备NaNO2:

(1)写出装置A烧瓶中发生反应的化学方程式并标出电子转移的方向和数目________。
(2)B装置的作用是______________________________。
(3)有同学认为装置C中产物不仅有亚硝酸钠,还有碳酸钠和氢氧化钠,为制备纯净NaNO2应在B、C装置间增加一个装置,请在框内画出增加的装置图,并标明盛放的试剂________。

(4)试设计实验检验装置C中NaNO2的存在(写出操作、现象和结论)________。
Ⅱ.含量的测定
称取装置C中反应后的固体4.000g溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol/L酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
滴定次数 | 1 | 2 | 3 | 4 |
KMnO4溶液体积/mL | 20.60 | 20.02 | 20.00 | 19.98 |
(5)第一组实验数据出现异常,造成这种异常的原因可能是________(双项选择)。
A.酸式滴定管用蒸馏水洗净后未用标准液润洗
B.锥形瓶洗净后未干燥
C.滴定终了仰视读数
D.滴定终了俯视读数
(6)根据表中数据,计算所得固体中亚硝酸钠的质量分数____________________。
(结果保留4位有效数字)
【题目】已知在温度低于570 ℃时,还原铁粉与水蒸气反应的产物是FeO,高于570 ℃时,生成Fe3O4。老师用上图所示实验装置,完成了还原铁粉与水蒸气反应的演示实验。
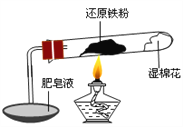
甲同学为探究实验后试管内的固体含有哪些物质,进行了下列实验:
实验编号 | 实验操作 | 实验现象 |
① | 取少量黑色粉末放入试管中,加入盐酸,微热 | 黑色粉末逐渐溶解,溶液呈浅绿色;有少量气泡产生 |
② | 向试管中滴加几滴KSCN溶液,振荡 | 溶液没有出现血红色 |
根据上述实验,下列说法不正确的是
A.试管内的固体一定含有铁粉
B.试管内的固体一定不含有Fe3O4
C.不能确定试管内的固体一定含有FeO
D.可通过将试管内固体彻底还原,分析其质量减小的方法来确定是否含有Fe3O4