题目内容
【题目】(1)已知拆开1mo1H-H键、1molN≡N键、lmolN-H键分别需要吸收的能量为436kJ、946kJ、391kJ。则生成1mo1 NH3时反应放出______________kJ 的热量。
(2)天然气既是高效洁净的能源,也是重要的化工原料。
①甲烷分子的结构式为_________,空间构型为_______________。
②甲烷高温分解生成氢气和炭黑。在密闭容器中进行此反应时要通入适量空气使部分甲烷燃烧,其目的是__________________________________________。
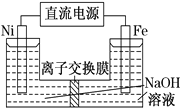
(3)为了验证Fe3+与Cu2+氧化性强弱,下列装置能达到实验目的的是________(填序号)。

(4)直接乙醇燃料电池(DEFC)具有很多优点,引起了人们的研究兴趣。现有以下三种乙醇燃料电池。

①三种乙醇燃料电池中正极反应物均为______________________;
②碱性乙醇燃料电池中,电极a上发生的电极反应式为_______________________;
③熔融盐乙醇燃料电池中若选择熔融碳酸钾为介质,电池工作时,电极b上发生的电极反应式为_______________________________________________。
【答案】46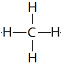 正四面体提供甲烷分解所需的能量②O2C2H5OH+16OH--12e-=2CO32-+11H2OO2+2CO2+4e-=2CO32-
正四面体提供甲烷分解所需的能量②O2C2H5OH+16OH--12e-=2CO32-+11H2OO2+2CO2+4e-=2CO32-
【解析】
(1)已知拆开1mo1H-H键、1molN≡N键、lmolN-H键分别需要吸收的能量为436kJ、946kJ、391kJ,根据反应热等于断键吸收的能量和形成化学键放出的能量的差值,则生成2mol氨气放出的热量是2×3×391kJ-3×436kJ-946kJ=92kJ,所以生成1mo1 NH3时反应放出46kJ的热量。
(2)①甲烷分子的化学式为CH4,结构式为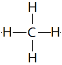 ,空间构型为正四面体。
,空间构型为正四面体。
②由于甲烷高温分解需要吸收能量,所以进行此反应时要通入适量空气使部分甲烷燃烧的目的是提供甲烷分解所需的能量。
(3)验证Fe3+与Cu2+氧化性强弱,在原电池中,铜作负极、其它导电的金属或非金属作正极,电解质溶液为可溶性的铁盐,则
①中铁作负极、Cu作正极,电池反应式为Fe+2Fe3+=3Fe2+,不能验证Fe3+与Cu2+氧化性强弱,错误;
②中铜作负极、银作正极,电池反应式为Cu+2Fe3+=Cu2++2Fe2+,能验证Fe3+与Cu2+氧化性强弱,正确;
③中铁发生钝化现象,Cu作负极、铁作正极,电池反应式为:Cu+2NO3-+4H+=Cu2++2NO2↑+2H2O,不能验证氧化性强弱,错误;
④中铁作负极、铜作正极,电池反应式为:Fe+Cu2+=Cu+Fe2+,不能验证Fe3+与Cu2+氧化性强弱,错误;
答案选②。
(4)①燃料电池中正极均是氧气得到发生还原反应,因此三种乙醇燃料电池中正极反应物均为O2;
②碱性乙醇燃料电池中,电极a上通入的是乙醇,乙醇发生失去电子的氧化反应转化为碳酸盐,则发生的电极反应式为C2H5OH+16OH--12e-=2CO32-+11H2O;
③熔融盐乙醇燃料电池中若选择熔融碳酸钾为介质,电池工作时,电极b上通入的是空气,氧气得到电子,由于负极产生的二氧化碳部分进入正极,则正极发生的电极反应式为O2+2CO2+4e-=2CO32-。

 阅读快车系列答案
阅读快车系列答案