题目内容
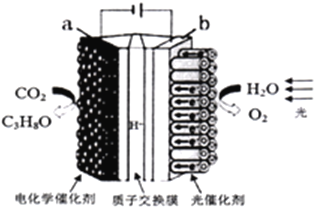
【题目】某同学利用如图所示实验装置测定常温常压下的气体摩尔体积。
根据下列步骤完成实验:
①装配好装置,检查气密性
②用砂纸擦去镁带表面的氧化物,然后取0.0480g的镁带加入仪器a中,分液漏斗内加入足量1mol/L硫酸溶液
③量气装置中加入适量水,记录量气管读数(读数为0.10mL)
④通过分液漏斗向仪器a中加入适量硫酸溶液,使镁带与硫酸充分反应
⑤当镁带完全反应后,再次记录量气管读数(读数为49.60mL)。

完成下列填空:
(1)仪器a的名称_______,通过分液漏斗向仪器a中加入硫酸溶液的操作是_______。
(2)在记录量气管读数时,应注意将_______,再________,视线与量气管内凹液面相切,水平读数。
(3)该同学测出此条件下气体摩尔体积为__________,测定结果比理论值偏大,可能的原因是(填字母代号)__________。
a.镁带中氧化膜未除尽 b.镁带含有杂质铝
c.③记录量气管读数时俯视读数 d.镁带完全反应后有残留的未溶固体
(4)与原方案装置相比,有同学设想用装置B代替装置A,实验精确度更高。请说明理由____________________。
【答案】 锥形瓶 将分液漏斗玻璃塞上的凹槽与漏斗口颈上的小孔对准(或将玻璃塞拔开),缓慢旋转分液漏斗的旋塞,使硫酸溶液缓慢流入锥形瓶,适时关闭旋塞。 装置冷却至室温 调节水准管高度,使其液面与量气管中液面相平 24.75 L· mol -1 b. c 避免加入硫酸时,液体所占的体积引入的实验误差
【解析】(1)结合仪器结构,可知仪器a为锥形瓶,操作时将分液漏斗玻璃塞上的凹槽与漏斗口颈上的小孔对准(或将玻璃塞拔开),缓慢旋转分液漏斗的旋塞,使硫酸溶液缓慢流入锥形瓶,适时关闭旋塞;
(2)待装置冷却后,再调节水准管高度,使其液面与量气管中液面相平,保持视线与量气管内凹液面相切,即可读数;
(3)0.0480g镁带的物质的量为![]() =0.002mol,气体的体积为(49.60mL-0.10mL)=49.50mL=0.0495L,此条件下气体摩尔体积为=
=0.002mol,气体的体积为(49.60mL-0.10mL)=49.50mL=0.0495L,此条件下气体摩尔体积为=![]() =24.75 L· mol -1;
=24.75 L· mol -1;
a.镁带中氧化膜未除尽,生成的氢气的体积偏小,摩尔体积偏小,故a错误;b.镁带含有杂质铝,导致生成的氢气偏多,摩尔体积偏大,故b正确;c.③记录量气管读数时俯视读数,导致读数偏大,生成的氢气偏多,摩尔体积偏大,故c正确;d.镁带完全反应后有残留的未溶固体,说明镁没有完全反应,生成的氢气体积偏小,摩尔体积偏小,故d错误;答案为bc;
(4)用装置B代替装置A,避免加入硫酸时,硫酸溶液所占的体积引入的实验误差,可提高实验精确度。

【题目】现代煤化工产生的H2S是一种重要的工业资源。请回答:
(1)用过量的NaOH吸收H2S,请写出该反应的离子方程式:____________。硫化钠又称臭碱,其溶液盛装在带橡胶塞的试剂瓶中,请用离子方程式解释其溶液呈碱性的原因为:_______。己知:25℃时,H2S的Ka1=1×10-7,Ka2=1×10-12,计算此温度时1mol/LNa2S溶液的pH=____。(结果取整数)
(2)用电解法处理Na2S溶液是处理硫化氢废气的一个重要环节。实验装置如图:

已知阳极的反应为xS2--2(x-1)e-=Sx2-,则阴极的电极反应式是_________,当反应转移nmole-时,产生标准状况下的气休体积为__________________。
(3)H2S是煤化工原料气脱硫过程的重要中间体。反应原理为:
①COS(g)+H2(g)![]() H2S(g)+CO(g) △H=+7kJ/mol
H2S(g)+CO(g) △H=+7kJ/mol
②CO(g)+H2O(g)![]() CO2(g)+H2(g) △H=-42kJ/mol
CO2(g)+H2(g) △H=-42kJ/mol
已知断裂1mol气态分子中的化学键所需能量如下表所示。
分子 | COS | H2 | H2O | CO | H2S | CO2 |
能量/kJ/mol | 1323 | 436 | 926 | X | 678 | 1606 |
计算表中x=____________。
(4)向2L容积不变的密闭容器中充入2molCOS(g),2molH2(g)和2molH2O(g),进行(3)中所述两个反应,其他条件不变,随着温度升高,CO的平衡体积分数增大,解释其原因为_____________。平衡体系中COS的物质的量为1.6mol时,CO的体积分数为5%,则H2O的平衡转化率为______,反应②的平衡常数为______(保留两位有效数字)。