题目内容
【题目】现代煤化工产生的H2S是一种重要的工业资源。请回答:
(1)用过量的NaOH吸收H2S,请写出该反应的离子方程式:____________。硫化钠又称臭碱,其溶液盛装在带橡胶塞的试剂瓶中,请用离子方程式解释其溶液呈碱性的原因为:_______。己知:25℃时,H2S的Ka1=1×10-7,Ka2=1×10-12,计算此温度时1mol/LNa2S溶液的pH=____。(结果取整数)
(2)用电解法处理Na2S溶液是处理硫化氢废气的一个重要环节。实验装置如图:
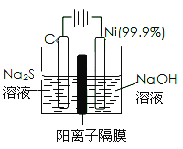
已知阳极的反应为xS2--2(x-1)e-=Sx2-,则阴极的电极反应式是_________,当反应转移nmole-时,产生标准状况下的气休体积为__________________。
(3)H2S是煤化工原料气脱硫过程的重要中间体。反应原理为:
①COS(g)+H2(g)![]() H2S(g)+CO(g) △H=+7kJ/mol
H2S(g)+CO(g) △H=+7kJ/mol
②CO(g)+H2O(g)![]() CO2(g)+H2(g) △H=-42kJ/mol
CO2(g)+H2(g) △H=-42kJ/mol
已知断裂1mol气态分子中的化学键所需能量如下表所示。
分子 | COS | H2 | H2O | CO | H2S | CO2 |
能量/kJ/mol | 1323 | 436 | 926 | X | 678 | 1606 |
计算表中x=____________。
(4)向2L容积不变的密闭容器中充入2molCOS(g),2molH2(g)和2molH2O(g),进行(3)中所述两个反应,其他条件不变,随着温度升高,CO的平衡体积分数增大,解释其原因为_____________。平衡体系中COS的物质的量为1.6mol时,CO的体积分数为5%,则H2O的平衡转化率为______,反应②的平衡常数为______(保留两位有效数字)。
【答案】 H2S + 2OH- = S2-+ 2H2O S2-+ H2O![]() HS-+OH- 13 2H2O+2e-= 2OH-+H2↑ 11.2 n L 1074 反应①吸热反应,升高温度,平衡正向动,CO的平衡体积分数增大;反应②为放热反应,升高温度,平衡逆向移动,CO的平衡体积分数也增大。 5% 0.30
HS-+OH- 13 2H2O+2e-= 2OH-+H2↑ 11.2 n L 1074 反应①吸热反应,升高温度,平衡正向动,CO的平衡体积分数增大;反应②为放热反应,升高温度,平衡逆向移动,CO的平衡体积分数也增大。 5% 0.30
【解析】(1)用过量的NaOH吸收H2S生成,Na2S,其中H2S为弱电解质,此反应的离子方程式为H2S + 2OH- = S2-+ 2H2O;硫化钠为强碱弱酸盐,在溶液中S2-水解使溶液显碱性,其水解反应的离子方程式为S2-+ H2O![]() HS-+OH-;[c(OH-)×c(HS-)]÷c(S2-)=Kw/Ka2,c(OH-)=
HS-+OH-;[c(OH-)×c(HS-)]÷c(S2-)=Kw/Ka2,c(OH-)=![]() mol/L=0.1mol/L,溶液的pH=12;
mol/L=0.1mol/L,溶液的pH=12;
(2)阴极是溶液中的H+得电子发生还原反应生成氢气,电极反应式是2H2O+2e-= 2OH-+H2↑,当反应转移nmole-时,生成氢气的物质的量为0.5nmol,产生标准状况下的气休体积为 0.5n mol×22.4L/mol=11.2 n L;
(3)已知COS(g)+H2(g)![]() H2S(g)+CO(g) △H=(1323+436)kJ/mol-(678+x)kJ/mol=+7kJ/mol,解得x=1074kJ/mol;
H2S(g)+CO(g) △H=(1323+436)kJ/mol-(678+x)kJ/mol=+7kJ/mol,解得x=1074kJ/mol;
(4)因反应①吸热反应,升高温度,平衡正向动,CO的平衡体积分数增大;反应②为放热反应,升高温度,平衡逆向移动,CO的平衡体积分数也增大,则其他条件不变,随着温度升高,CO的平衡体积分数增大;
① COS(g)+H2(g)![]() H2S(g)+CO(g)
H2S(g)+CO(g)
起始时(mol) 2 2 0 0
变化时(mol) 0.4 0.4 0.4 0.4
平衡时(mol) 1.6 1.6 0.4 0.4
CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
起始时(mol) 0.4 2 0 1.6
变化时(mol) n n n n
平衡时(mol) 0.4-n 2-n n 1.6+n
CO的体积分数为![]() ×100%=5%,解得n=0.1mol,则H2O的平衡转化率为
×100%=5%,解得n=0.1mol,则H2O的平衡转化率为![]() ×100%=5%;反应②的平衡常数K=
×100%=5%;反应②的平衡常数K=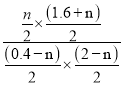 =0.3。
=0.3。

【题目】碳和氮的化合物在生产生活中广泛存在。回答下列问题:
(1)①氯胺(NH2Cl)的电子式为_______。
②工业上可利用Cl2和NH3反应制备氯胺,该反应的化学方程式为_______。
(2)一定条件下,不同物质的量的CO2与不同体积的1.0 mol·L-1 NaOH溶液充分反应放出的热量如下表所示:
反应序号 | CO2的物质的量/mol | NaOH溶液的体积/L | 放出的热量/kJ |
1 | 0.5 | 0.75 | x |
2 | 1.0 | 2.00 | y |
该条件下CO2与NaOH溶液反应生成NaHCO3的热化学反应方程式为__________。
(3)用焦炭还原NO的反应为:2NO(g) + C(s) ![]() N2(g) + CO2(g),向容积均为1 L的甲、乙、丙三个恒温(反应温度分别为400 ℃、T ℃、400 ℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g) + CO2(g),向容积均为1 L的甲、乙、丙三个恒温(反应温度分别为400 ℃、T ℃、400 ℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
t/min | 0 | 40 | 80 | 120 | 160 |
n(NO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n(NO)(乙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
n(NO)(丙容器)/ml | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
①甲容器中,0~40 min内用NO的浓度变化表示的平均反应速率v(NO)=_________。
②该反应的ΔH___0 (填“>”或“<”)。
③丙容器达到平衡时,NO的转化率为___________。
(4)常温下,在NH4HCO3溶液中,c(NH4+)________c(HCO3-) (填“>”、“<”或“=”);反应NH4++HCO3-+H2O ![]() NH3·H2O+H2CO3的平衡常数K=__________。(已知常温下,NH3·H2O的电离平衡常数Kb = 2×10-5,H2CO3的电离平衡常数Ka1 = 4×10-7,Ka2 = 4×10-11)
NH3·H2O+H2CO3的平衡常数K=__________。(已知常温下,NH3·H2O的电离平衡常数Kb = 2×10-5,H2CO3的电离平衡常数Ka1 = 4×10-7,Ka2 = 4×10-11)
【题目】钛对于酸、碱具有较强的耐腐蚀性,密度小,比强度高。已成为化工生产中重要的材料。回答下列问题:
(1)基态钛原子的价电子排布式为______________,其原子核外未成对电子有_____个。金属钛晶胞如图所示,晶胞参数为a=b=295.08pm,c=468.55pm,α=β=90°,γ=120°。金属钛为____堆积(填堆积方式),其中钛原子的配位数为________。

(2)用熔融的镁在氩气中还原TiCl4可得到多空的海绵钛。已知TiCl4在通常情况下是无色液体,熔点为-23℃,沸点为136℃,可知TiCl4为______晶体。
(3)通过X-射线探明KCl、CaO、TiN晶体与NaCl晶体结构相似,且知两种离子晶体的晶格能数据如下:
离子晶体 | KCl | CaO |
晶格能(kJ/mol) | 715 | 3401 |
解释KCl晶格能小于CaO的原因_________________________。
钛可与C、N、O等元素形成二元化合物。C、N、O元素的电负性由大到小的顺序是________。
(4)钙钛矿晶体的结构如图所示。晶体的化学式为___________。
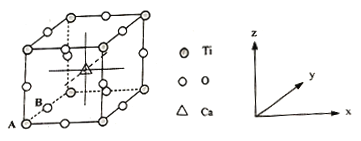
晶胞中的原子可用x、y、z组成的三数组来表达它在晶胞中的位置,称为原子坐标。已知原子坐标为A(0,0,0);B(0,1/2,0);则Ca离子的原子坐标为_____________。