题目内容
【题目】实验室配制500 mL 0.2 mol/L的FeSO4溶液,实验操作步骤有:
①在天平上称出27.8 g绿矾,把它放在烧杯里,用适量的蒸馏水使它完全溶解
②把制得的溶液小心地注入500 mL容量瓶中
③继续向容量瓶中加蒸馏水至液面距刻度1~2 cm处。改用胶头滴管小心滴加蒸馏水至溶液
凹液面底部与刻度线相切
④用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心转入容量瓶并轻轻摇匀
⑤将容量瓶塞塞紧,充分摇匀
请填写下列空白:
(1)操作步骤的正确顺序为(填序号)________________________。
(2)本实验用到的基本仪器有__________________________________________。
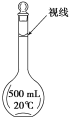
(3)某同学观察液面的情况如图所示,对所配溶液浓度有何影响?会________(填“偏高”、“偏低”或“无影响”)。
(4)若出现如下情况,所配溶液浓度将偏高还是偏低:
没有进行操作步骤④,会________; 加蒸馏水时不慎超过了刻度,会______。
(5)若实验过程中出现如下情况应如何处理?
加蒸馏水时不慎超过了刻度,应____________________________________;向容量瓶中转移溶液时(实验步骤②)不慎有液滴掉在容量瓶外面, 应________________。
【答案】①②④③⑤ 天平、药匙、烧杯、玻璃棒、500 mL容量瓶、胶头滴管 偏高 偏低 偏低 宣告实验失败,从头重新做 宣告实验失败,从头重做
【解析】
(1)根据配制一定物质的量浓度的溶液的配制步骤进行排序;
(2)根据配制一定物质的量浓度的溶液的配制步骤选择需要仪器;
(3)俯视刻度线导致溶液体积偏小,依据![]() 进行误差分析;
进行误差分析;
(4)分析操作对溶质的物质的量和溶液体积的影响,依据![]() 进行误差分析;
进行误差分析;
(5)任何不当操作导致实验失败且无法补救的都必须重新配制。
(1)配制一定物质的量浓度溶液的步骤为:计算、称量、溶解、转移、洗涤、定容、摇匀等,所以操作步骤和正确顺序为:①②④③⑤,故答案为:①②④③⑤;
(2)配制一定物质的量浓度的溶液的配制步骤:计算、称量、溶解、转移、洗涤、定容、摇匀,用到的仪器:托盘天平、药匙、烧杯、玻璃棒、500mL容量瓶、胶头滴管,故答案为:托盘天平、药匙、烧杯、玻璃棒、500mL容量瓶、胶头滴管;
(3)图中同学俯视刻度线,导致溶液体积偏小,依据![]() 溶液浓度偏高;故答案为:偏高;
溶液浓度偏高;故答案为:偏高;
(4)没有进行洗涤操作,导致溶质的物质的量偏小,溶液浓度偏低;加蒸馏水时不慎超过了刻度,导致溶液体积偏大,溶液浓度偏低;故答案为:偏低;偏低;
(5)若实验过程中出现加蒸馏水时不慎超过了刻度,导致溶液失败且无法补救,所以应重新配制;向容量瓶中转移溶液时(实验步骤②)不慎有液滴掉在容量瓶外面,导致溶液失败且无法补救,所以应重新配制;
故答案为:宣告实验失败,从头重新做;宣告实验失败,从头重新做。