题目内容
【题目】常温下,向二元弱酸H2Y溶液中滴加 KOH 溶液,所得混合溶液的 pH 与 P[P=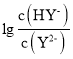 或
或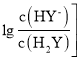 变化关系如图所示。下列说法正确的是
变化关系如图所示。下列说法正确的是
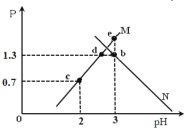
A.曲线 M 表示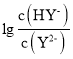 随 pH 的变化关系
随 pH 的变化关系
B.Ka2 的数值是10-6
C.e 点溶液中:2c(Y2-)+c(HY-)﹣c(K+)+c(OH-)=0.001mol·L-1
D.KHY 溶液中:c(K+)>c(HY﹣)>c(H+)>c(Y2-)>c(H2Y)
【答案】CD
【解析】
随着pH的增大,H2Y的电离程度逐渐增大,溶液中的 逐渐增大,
逐渐增大,  逐渐减小,则lg
逐渐减小,则lg 逐渐增大,因此曲线M表示pH与lg
逐渐增大,因此曲线M表示pH与lg 的变化关系,lg
的变化关系,lg 逐渐减小,曲线N表示pH与lg
逐渐减小,曲线N表示pH与lg 的变化关系。
的变化关系。
A.随着pH的增大,H2Y的电离程度逐渐增大,溶液中的 逐渐增大,
逐渐增大,  逐渐减小,则lg
逐渐减小,则lg 逐渐增大,因此曲线M表示pH与lg
逐渐增大,因此曲线M表示pH与lg 的变化关系,lg
的变化关系,lg 逐渐减小,曲线N表示pH与lg
逐渐减小,曲线N表示pH与lg 的变化关系,故A错误;
的变化关系,故A错误;
B.由H2Y![]() H++HY-、HY-
H++HY-、HY-![]() H++Y2-可知,Ka2=
H++Y2-可知,Ka2=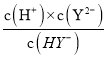 根据题中图示,pH=3时,c(H+)=10-3mol/L,lg
根据题中图示,pH=3时,c(H+)=10-3mol/L,lg =1.3,则
=1.3,则 =101.3,Ka2=
=101.3,Ka2=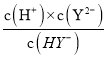 =
= ![]() =10-4.3,故B错误;
=10-4.3,故B错误;
C.e 点溶液中,存在K+、H+、Y2-、HY-、OH-,溶液呈现电中性的,由电荷守恒得c(K+)+c(H+)=2c(Y2-)+c(HY-)+c(OH-),e 点pH=3,c(H+)=0.001mol·L-1,则c(H+)=2c(Y2-)+c(HY-)+c(OH-)- c(K+),所以2c(Y2-)+c(HY-)+c(OH-)-c(K+)=0.001 mol·L-1,故C正确;
D.KHY溶液中,HY-的水解常数Kh2=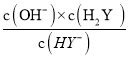 ,根据图象中c点坐标可知,pH=2时lg
,根据图象中c点坐标可知,pH=2时lg =0.7,则c(OH-)=110-12mol/L、
=0.7,则c(OH-)=110-12mol/L、 =100.7,代入水解常数的计算公式可得Kh2=
=100.7,代入水解常数的计算公式可得Kh2=![]() ,HY-的水解常数小于其电离常数,所以HY-的电离程度大于其水解程度,KHY溶液呈现酸性,则溶液中c(Y2-)>c(H2Y),由于还存在水的电离,c(H+)>c(Y2-),所以KHY 溶液中:c(K+)>c(HY﹣)>c(H+)>c(Y2-)>c(H2Y),故D正确;
,HY-的水解常数小于其电离常数,所以HY-的电离程度大于其水解程度,KHY溶液呈现酸性,则溶液中c(Y2-)>c(H2Y),由于还存在水的电离,c(H+)>c(Y2-),所以KHY 溶液中:c(K+)>c(HY﹣)>c(H+)>c(Y2-)>c(H2Y),故D正确;
答案为CD。