题目内容
(16分)(1)反应A(g)+B(s) C(g);△H<0,在其他条件不变时,改变其中一个条件,则生成C的速率:
C(g);△H<0,在其他条件不变时,改变其中一个条件,则生成C的速率:
①升温____________;②增大压强____________;③增大容器容积____________;
④加入A____________; ⑤加入B____________; ⑥加正催化剂____________。
(2)在25℃、101kPa下,1g甲烷燃烧生成CO2和液态水时放热55.6kJ。则表示甲烷燃烧热的热化学方程式为___________________________________________。
(3)北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6),丙烷脱氢可得丙烯。
已知:C3H8(g)=CH4(g)+HC CH(g)+H2(g) △H1="+156.6" kJ·mol-1
CH(g)+H2(g) △H1="+156.6" kJ·mol-1
CH3CH CH2(g)= CH4(g)+HC
CH2(g)= CH4(g)+HC CH(g ) △H2="+32.4" kJ·mol-1
CH(g ) △H2="+32.4" kJ·mol-1
则相同条件下,反应C3H8(g)=CH3CH CH2(g)+H2(g) 的△H= kJ·mol-1。
CH2(g)+H2(g) 的△H= kJ·mol-1。
(4)下表中的数据表示破坏1 mol化学键需消耗的能量(即键能,单位为kJ·mol-1):
根据键能数据计算以下反应的反应热△H:
CH4(g)+4F2(g)﹦CF4(g)+4HF(g) △H=______________________
 C(g);△H<0,在其他条件不变时,改变其中一个条件,则生成C的速率:
C(g);△H<0,在其他条件不变时,改变其中一个条件,则生成C的速率:①升温____________;②增大压强____________;③增大容器容积____________;
④加入A____________; ⑤加入B____________; ⑥加正催化剂____________。
(2)在25℃、101kPa下,1g甲烷燃烧生成CO2和液态水时放热55.6kJ。则表示甲烷燃烧热的热化学方程式为___________________________________________。
(3)北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6),丙烷脱氢可得丙烯。
已知:C3H8(g)=CH4(g)+HC
 CH(g)+H2(g) △H1="+156.6" kJ·mol-1
CH(g)+H2(g) △H1="+156.6" kJ·mol-1CH3CH
 CH2(g)= CH4(g)+HC
CH2(g)= CH4(g)+HC CH(g ) △H2="+32.4" kJ·mol-1
CH(g ) △H2="+32.4" kJ·mol-1则相同条件下,反应C3H8(g)=CH3CH
 CH2(g)+H2(g) 的△H= kJ·mol-1。
CH2(g)+H2(g) 的△H= kJ·mol-1。(4)下表中的数据表示破坏1 mol化学键需消耗的能量(即键能,单位为kJ·mol-1):
| 化学键 | C—H | C—F | H—F | F—F |
| 键能 | 414 | 489 | 565 | 158 |
CH4(g)+4F2(g)﹦CF4(g)+4HF(g) △H=______________________
(1)加快、加快、减慢、加快、不变、加快 (1分/每空)
(2)CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=–889.6kJ·mol-1(4分)
(3)124.2(3分) (4)—1928 KJ/mol(3分)
(2)CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=–889.6kJ·mol-1(4分)
(3)124.2(3分) (4)—1928 KJ/mol(3分)
(1)考查外界条件对反应速率的影响.升高温度反应速率加快.有气体参加或生成的反应,增大压强反应速率加快.增大容器的容积,则压强降低,反应速率降低.增加A反应速率增大.由于B是固体,改变B的质量,反应速率不变.加热正催化剂能加快反应速率.
(2)燃烧热是指在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量.所以1mol甲烷完全燃烧放出的热量是55.6kJ×16=889.6kJ,因此热化学方程式为CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=–889.6kJ·mol-1.
(3)考查盖斯定律的应用.根据反应①C3H8(g)=CH4(g)+HC CH(g)+H2(g)和反应②CH3CH
CH(g)+H2(g)和反应②CH3CH CH2(g)= CH4(g)+HC
CH2(g)= CH4(g)+HC CH(g )可知,即①-②即得到C3H8(g)=CH3CH
CH(g )可知,即①-②即得到C3H8(g)=CH3CH CH2(g)+H2(g),所以该反应热是+156.6 kJ·mol-1-32.4 kJ·mol-1="124.3" kJ·mol-1.
CH2(g)+H2(g),所以该反应热是+156.6 kJ·mol-1-32.4 kJ·mol-1="124.3" kJ·mol-1.
(4)反应热就是断键吸收的能量和形成化学键所放出的能量的差值,因此该反应的反应热是414 kJ·mol-1×4+158 kJ·mol-1×4-489 kJ·mol-1×4-565 kJ·mol-1×4=—1928 KJ/mol。
(2)燃烧热是指在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量.所以1mol甲烷完全燃烧放出的热量是55.6kJ×16=889.6kJ,因此热化学方程式为CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=–889.6kJ·mol-1.
(3)考查盖斯定律的应用.根据反应①C3H8(g)=CH4(g)+HC
 CH(g)+H2(g)和反应②CH3CH
CH(g)+H2(g)和反应②CH3CH CH2(g)= CH4(g)+HC
CH2(g)= CH4(g)+HC CH(g )可知,即①-②即得到C3H8(g)=CH3CH
CH(g )可知,即①-②即得到C3H8(g)=CH3CH CH2(g)+H2(g),所以该反应热是+156.6 kJ·mol-1-32.4 kJ·mol-1="124.3" kJ·mol-1.
CH2(g)+H2(g),所以该反应热是+156.6 kJ·mol-1-32.4 kJ·mol-1="124.3" kJ·mol-1.(4)反应热就是断键吸收的能量和形成化学键所放出的能量的差值,因此该反应的反应热是414 kJ·mol-1×4+158 kJ·mol-1×4-489 kJ·mol-1×4-565 kJ·mol-1×4=—1928 KJ/mol。

练习册系列答案
相关题目
 CO(g) + H2(g) △H>0,既要提高反应速率又要提高H2O的转化率,下列措施中可行的是 ( )
CO(g) + H2(g) △H>0,既要提高反应速率又要提高H2O的转化率,下列措施中可行的是 ( )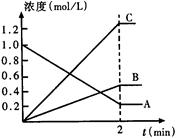
 2Z(g) △H<0 ,为了使平衡向生成Z的方向移动,应选择下列的适宜条件是( )
2Z(g) △H<0 ,为了使平衡向生成Z的方向移动,应选择下列的适宜条件是( ) 2HI(g); △H<0并达平衡。HI的体积分数
2HI(g); △H<0并达平衡。HI的体积分数 随时间变化如图曲线(II)所示。若改变反应条件,在甲条件下
随时间变化如图曲线(II)所示。若改变反应条件,在甲条件下
 E(g);当反应进行到4min时达到平衡,测知M的浓度为0.2mol·L—1。下列说法正确的是
E(g);当反应进行到4min时达到平衡,测知M的浓度为0.2mol·L—1。下列说法正确的是  2NH3(g),平衡时测得N2的转化率为12%,则在相同温度和压强下,平衡时混合气体的体积是反应前的
2NH3(g),平衡时测得N2的转化率为12%,则在相同温度和压强下,平衡时混合气体的体积是反应前的 N2O4(g)△H<0。
N2O4(g)△H<0。
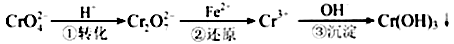
 Cr2O72—(橙色)+H2O
Cr2O72—(橙色)+H2O