题目内容
【题目】(1)结合表中给出的电离平衡常数回答下列问题:
酸或碱 | CH3COOH | HNO2 | HCN | HClO |
电离平衡常数(Ka或Kb) | 1.8×10-5 | 4.6×10-4 | 5×10-10 | 3×10-8 |
①上述四种酸中,酸性最弱、最强的酸分别是_______、_______(用化学式表示)。
②下列能使醋酸溶液中CH3COOH的电离程度增大,而电离平衡常数不变的操作是____(填序号)。
A.升高温度 B.加水稀释 C.加少量的CH3COONa固体
D.加少量冰醋酸 E.加氢氧化钠固体
③依上表数据判断醋酸和次氯酸钠溶液能否反应,如果不能反应说出理由,如果能发生反应请写出相应的离子方程式___________________________________。
(2) 某学习小组利用酸性KMnO4和H2C2O4反应来探究“外界条件对化学反应速率的影响”。 实验时,先分别量取KMnO4酸性溶液、H2C2O4溶液,然后倒入大试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。
①已知草酸H2C2O4是一种二元弱酸,写出草酸的电离方程式__________、___________。酸性KMnO4溶液和H2C2O4溶液反应的离子方程式为:_____________________________
某同学设计了如下实验
实验编号 | H2C2O4溶液 | KMnO4溶液 | 温度/℃ | ||
浓度(mol/L) | 体积(mL) | 浓度(mol/L) | 体积(mL) | ||
a | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
b | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
c | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
②探究浓度对化学反应速率影响的组合实验编号是__________,可探究温度对化学反应速率影响的实验编号是__________。
③实验a测得混合后溶液褪色的时间为40 s,忽略混合前后体积的微小变化,则这段时间内的平均反应速率v(KMnO4)=______ mol·L-1·min-1。
④在实验中,草酸(H2C2O4)溶液与KMnO4酸性溶液反应时,褪色总是先慢后快,其可能的原因是___________________________________
【答案】HCNHNO2 BECH3COOH + ClO-= HClO + CH3COO-H2C2O4![]() H+ + HC2O4- HC2O4-
H+ + HC2O4- HC2O4- ![]() H+ + C2O42-2MnO4 -+5H2C2O4+6H+=2Mn2++10CO2↑+8H2Oa和bb和c0.01mol·L-1·min-1反应生成的Mn2+对该反应有催化作用
H+ + C2O42-2MnO4 -+5H2C2O4+6H+=2Mn2++10CO2↑+8H2Oa和bb和c0.01mol·L-1·min-1反应生成的Mn2+对该反应有催化作用
【解析】
(1)①对于一元弱酸,电离平衡常数越大则酸性越强,反之则酸性越弱,HCN的电离平衡常数最小,则酸性最弱;HNO2的电离平衡常数最大,则酸性最强;故答案为:HCN、HNO2;
②A.升高温度,电离程度增大,电离平衡常数增大;B.加水稀释,电离程度增大,电离平衡常数不变;C.加少量的CH3COONa固体,电离出的醋酸根对醋酸的电离平衡起抑制作用,电离程度减小,电离平衡常数不变;D.加少量冰醋酸,则醋酸浓度增大,则电离程度减小,平衡常数不变;E.加氢氧化钠固体,使溶液中氢离子浓度减少,电离平衡正向移动,电离子程度增大;综上所述,答案为:BE;
③由表中电离平衡常数可在酸性:醋酸>次氯酸,故醋酸和次氯酸钠溶液能发生反应,方程式为:CH3COOH + ClO-= HClO + CH3COO-;故答案为:CH3COOH + ClO-= HClO + CH3COO-;
(2)①草酸H2C2O4是一种二元弱酸,电离时分步进行,其电离方程式为:H2C2O4![]() H+ + HC2O4- 、HC2O4-
H+ + HC2O4- 、HC2O4- ![]() H+ + C2O42-;在酸性条件下,高锰酸根离子能和草酸发生氧化还原反应生成二价锰离子、二氧化碳和水,离子方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;故答案为:H2C2O4
H+ + C2O42-;在酸性条件下,高锰酸根离子能和草酸发生氧化还原反应生成二价锰离子、二氧化碳和水,离子方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;故答案为:H2C2O4![]() H+ + HC2O4- 、HC2O4-
H+ + HC2O4- 、HC2O4- ![]() H+ + C2O42-;2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;
H+ + C2O42-;2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;
②由表中实验条件对比可知:实验a和b仅反应物的浓度不同,b与c仅实验的温度不同,故答案为:a和b、b和c;
③根据已知数据可得v(KMnO4)=![]() =0.01mol·L-1·min-1,故答案为:0.01mol·L-1·min-1;
=0.01mol·L-1·min-1,故答案为:0.01mol·L-1·min-1;
④在其它条件都相同时,开始速率很小,过一会儿速率突然增大,说明反应生成了具有催化作用的物质,其中水在反应前后都存在,CO2释放出去了,所以可能起催化作用的是Mn2+,故答案为:反应生成的Mn2+对该反应有催化作用。

【题目】中共十九大报告指出,加快水污染防治、实施流域环境和近岸海域综合治理、环境污染的治理是化学工作者研究的重要课题,也是践行“绿水青山就是金山银山”的重要举措。在适当的条件下,将CO2转化为甲醇、甲醚等有机物,既可降低CO2造成的温室效应对环境的影响,还可得到重要的有机产物。
(1)已知:①2H2(g)+O2(g)=2H2O(g) ΔH1=484 kJ/mol
②CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH2=50 kJ/mol
CH3OH(g)+H2O(g) ΔH2=50 kJ/mol
则2CH3OH(g)+3O2(g)= 2CO2(g)+4H2O(g) ΔH,ΔH=_____________。
(2)已知T K时,某恒容密闭容器中存在如下反应:2CO2(g)+6H2(g) ![]() CH3OCH3(g)+3H2O(g) ΔH<0,测得容器中不同时刻时各物质的浓度(mol/L)如下表所示:
CH3OCH3(g)+3H2O(g) ΔH<0,测得容器中不同时刻时各物质的浓度(mol/L)如下表所示:
c(CO2) | c(H2) | c(CH3OCH3) | c(H2O) | |
开始时 | a | b | 0 | 0 |
10 s时 | 3 | 0.5 | c | 1.5 |
①若反应开始到10s时间段内,v(H2)=_____________,既能提高反应速率,又能提高H2转化率的方法是________________________。
②若T K时,化学平衡常数K=15,则10 s 时v(正)_______v(逆)(填“>”“<”或“=”),此时CO2的转化率为________。
(3)一定条件下,向某恒容密闭容器中充入x mol CO2和y mol H2,发生的反应为CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH=50 kJ·mol1。
CH3OH(g)+H2O(g) ΔH=50 kJ·mol1。
①下图1中能表示该反应的平衡常数K与温度T之间的变化关系曲线为______(填“a”或“b”),其判断依据是__________________________________。
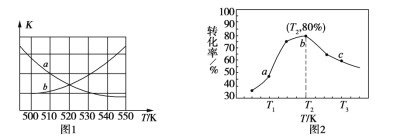
②若x=2、y=3,测得在相同时间内不同温度下H2的转化率如图2所示,则在该时间段内,恰好达到化学平衡时,容器内的压强与反应开始时的压强之比为____________。