题目内容
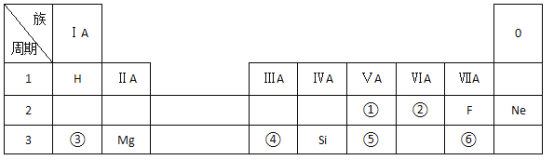
【题目】随着原子序数的递増,八种短周期元素(用字母x、y、z…表示)的原子半径的相对大小、最高正价或最低负价的变化如下图所示。请根据判断出的元素回答下列问题

(1)f在元素周期表中的位置是第三周期第____族。
(2)比较d、e常见离子的半径大小:_______(用化学符号表示且用“>”连接,下同)。比较g、h的最高价氧化物对应的水化物的酸性强弱:_______
(3)写出x与z形成的常见四原子共价化合物的电子式_______
(4)物质A是一种常用的比水轻的有机溶剂,其仅由x、y两种元素组成,且y元素与x元素的质量比为12:1,A的相对分子质量为78。A与浓硫酸、浓硝酸在50~60℃下发生反应的化学方程式为__________,反应类型为__________。
(5)f的最高价氧化物对应的水化物可以与e的最高价氧化物对应的水化物反应,请写出该反应的离子方程式:_______________。
【答案】ⅢA O2->Na+ HClO4>H2SO4 ![]()
 取代反应 Al(OH)3 +OH- = AlO2- + 2H2O
取代反应 Al(OH)3 +OH- = AlO2- + 2H2O
【解析】
从图中的化合价和原子半径的大小,可以推出x是H元素,y是C元素,z是N元素,d是O元素,e是Na元素,f是Al元素,g是S元素,h是Cl元素,据此回答各题。
(1) f是Al元素,在元素周期表的位置是第三周期 ⅢA族;
(2) 电子层结构相同的离子,核电荷数越大离子半径越小,故r(O2-)>r(Na+);非金属性越强,最高价氧化物水化物的酸性越强,故HClO4>H2SO4;
(3) 四原子共价化合物是NH3其电子式为: ![]() ;
;
(4) y元素与x元素的质量比为12:1,可推知![]() 所以A的最简式为CH, 又根据A的相对分子质量为78,可推知A的分子式为C6H6,A是一种常用的比水轻的有机溶剂,可知A是苯,结构简式为:
所以A的最简式为CH, 又根据A的相对分子质量为78,可推知A的分子式为C6H6,A是一种常用的比水轻的有机溶剂,可知A是苯,结构简式为:![]() 。A与浓硫酸、浓硝酸在50~60℃下发生反应的化学方程式为
。A与浓硫酸、浓硝酸在50~60℃下发生反应的化学方程式为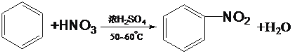 ,反应类型为取代反应;
,反应类型为取代反应;
(5) f的最高价氧化物对应的水化物为Al(OH)3,e的最高价氧化物对应的水化物为NaOH,该反应的离子方程式:Al(OH)3 + OH- = AlO2- + 2H2O。

 名校课堂系列答案
名校课堂系列答案【题目】(1)结合表中给出的电离平衡常数回答下列问题:
酸或碱 | CH3COOH | HNO2 | HCN | HClO |
电离平衡常数(Ka或Kb) | 1.8×10-5 | 4.6×10-4 | 5×10-10 | 3×10-8 |
①上述四种酸中,酸性最弱、最强的酸分别是_______、_______(用化学式表示)。
②下列能使醋酸溶液中CH3COOH的电离程度增大,而电离平衡常数不变的操作是____(填序号)。
A.升高温度 B.加水稀释 C.加少量的CH3COONa固体
D.加少量冰醋酸 E.加氢氧化钠固体
③依上表数据判断醋酸和次氯酸钠溶液能否反应,如果不能反应说出理由,如果能发生反应请写出相应的离子方程式___________________________________。
(2) 某学习小组利用酸性KMnO4和H2C2O4反应来探究“外界条件对化学反应速率的影响”。 实验时,先分别量取KMnO4酸性溶液、H2C2O4溶液,然后倒入大试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。
①已知草酸H2C2O4是一种二元弱酸,写出草酸的电离方程式__________、___________。酸性KMnO4溶液和H2C2O4溶液反应的离子方程式为:_____________________________
某同学设计了如下实验
实验编号 | H2C2O4溶液 | KMnO4溶液 | 温度/℃ | ||
浓度(mol/L) | 体积(mL) | 浓度(mol/L) | 体积(mL) | ||
a | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
b | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
c | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
②探究浓度对化学反应速率影响的组合实验编号是__________,可探究温度对化学反应速率影响的实验编号是__________。
③实验a测得混合后溶液褪色的时间为40 s,忽略混合前后体积的微小变化,则这段时间内的平均反应速率v(KMnO4)=______ mol·L-1·min-1。
④在实验中,草酸(H2C2O4)溶液与KMnO4酸性溶液反应时,褪色总是先慢后快,其可能的原因是___________________________________
【题目】一定温度下,在1L恒容密闭容器中加入lmol的N2(g)和3molH2(g)发生反应:N2(g)+3H2(g) ![]() 2NH3(g) △H<0, NH3的物质的量与时间的关系如下表所示,下列说法不正确的是( )
2NH3(g) △H<0, NH3的物质的量与时间的关系如下表所示,下列说法不正确的是( )
时间(min) | 0 | t1 | t2 | t3 |
NH3物质的量(mol) | 0 | 0.2 | 0.3 | 0.3 |
A. 0t1min,v(NH3)=0.2/t1mol·L-1·min-1
B. t3时再加入1mol的N2(g)和3molH2(g),反应达新平衡时,c(N2)>0.85mol·L-1
C. N2(g)+3H2(g) ![]() 2NH3(g)的活化能小于2NH3(g)
2NH3(g)的活化能小于2NH3(g) ![]() N2(g)+3H2(g)的活化能
N2(g)+3H2(g)的活化能
D. 升高温度,可使正反应速率减小,逆反应速率增大,故平衡逆移