题目内容
10.已知:2SO2(g)+O2(g)?2SO3(g)△H=-197kJ•mol-1.实验测得4mol SO2参加上述反应放出354kJ热量,则SO2的转化率最接近于( )| A. | 90% | B. | 80% | C. | 50% | D. | 40% |
分析 根据反应放出的热量计算转化的二氧化硫物质的量,转化率=$\frac{物质的量变化量}{起始物质的量}$×100%.
解答 解:反应放出354kJ热量,则消耗的二氧化硫为2mol×$\frac{354kJ}{197kJ}$=3.6mol,故二氧化硫的转化率为$\frac{3.6mol}{4mol}$×100%=90%,故选:A.
点评 本题考查化学平衡计算,关键是对热化学方程式的理解,比较基础.

练习册系列答案
相关题目
1.下列离子方程式正确的是( )
| A. | 稀硫酸与氢氧化铜反应:H++OH-═H2O | |
| B. | 钠与水反应:Na+H2O═Na++OH-+H2↑ | |
| C. | 碳酸钙与盐酸反应:CO32 -+2H+═H2O+CO2↑ | |
| D. | 碳酸钾与硝酸:CO32-+2H+═H2O+CO2↑ |
2.X、Y、Z都是气体,反应前X、Y的物质的量之比是1:2,在一定条件下可逆反应X+2Y?2Z达到平衡时,测得反应物总的物质的量等于生成物总的物质的量,则平衡时X的转化率是( )
| A. | 80% | B. | 20% | C. | 40% | D. | 60% |
19.草酸亚铁晶体(FeC2O4•2H2O)呈淡黄色.某课题组为探究草酸亚铁晶体的化学性质,进行了一系列实验探究.
(1)向盛有草酸亚铁晶体的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现溶液颜色逐渐变为棕黄色,并检测到二氧化碳气体生成.这说明草酸亚铁晶体具有还原性(填“氧化性”、“还原性”或“碱性”).若反应中消耗1.5mol FeC2O4•2H2O,则参加反应的KMnO4为0.9mol.
(2)资料表明:在密闭容器中加热到一定温度时,草酸亚铁晶体可完全分解,生成几种氧化物,残留物为黑色固体.课题组根据课本上所介绍的铁的氧化物的性质,对黑色固体的组成提出如下假设,请你完成假设二和假设三:
假设一:全部是FeO 假设二:全部是Fe3O4 假设三:FeO和Fe3O4
(3)为验证上述假设一是否成立,课题组进行如下研究.
【定性研究】请你完成如表中内容.
【定量研究】课题组在文献中查阅到,FeC2O4•2H2O受热分解时,固体质量随温度变化的曲线如图所示,写出加热到400℃时,FeC2O4•2H2O晶体受热分解的化学方程式为:FeC2O4•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$FeO+CO↑+CO2↑+2H2O或FeC2O4$\frac{\underline{\;\;△\;\;}}{\;}$FeO+CO↑+CO2↑.
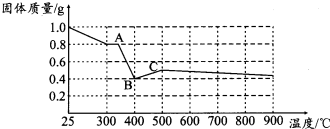
根据图象,如有1.0g草酸亚铁晶体在坩埚中敞口充分加热,最终残留黑色固体的质量大于0.4g.某同学由此得出结论:假设一不成立.你是否同意该同学的结论,并简述理由:不同意,实验未在密闭容器中进行,FeO会被空气中的氧气进一步氧化,生成的铁的其它氧化物.
(1)向盛有草酸亚铁晶体的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现溶液颜色逐渐变为棕黄色,并检测到二氧化碳气体生成.这说明草酸亚铁晶体具有还原性(填“氧化性”、“还原性”或“碱性”).若反应中消耗1.5mol FeC2O4•2H2O,则参加反应的KMnO4为0.9mol.
(2)资料表明:在密闭容器中加热到一定温度时,草酸亚铁晶体可完全分解,生成几种氧化物,残留物为黑色固体.课题组根据课本上所介绍的铁的氧化物的性质,对黑色固体的组成提出如下假设,请你完成假设二和假设三:
假设一:全部是FeO 假设二:全部是Fe3O4 假设三:FeO和Fe3O4
(3)为验证上述假设一是否成立,课题组进行如下研究.
【定性研究】请你完成如表中内容.
| 实验步骤(不要求写出具体操作过程) | 预期实验现象和结论 |
| 取少量黑色固体加入足量稀盐酸(或稀硫酸)溶解, 在溶液中滴加KSCN溶液 | 若溶液不变红色,则假设一成立. 若溶液变红色,则假设一不成立 |

根据图象,如有1.0g草酸亚铁晶体在坩埚中敞口充分加热,最终残留黑色固体的质量大于0.4g.某同学由此得出结论:假设一不成立.你是否同意该同学的结论,并简述理由:不同意,实验未在密闭容器中进行,FeO会被空气中的氧气进一步氧化,生成的铁的其它氧化物.