题目内容
2.X、Y、Z都是气体,反应前X、Y的物质的量之比是1:2,在一定条件下可逆反应X+2Y?2Z达到平衡时,测得反应物总的物质的量等于生成物总的物质的量,则平衡时X的转化率是( )| A. | 80% | B. | 20% | C. | 40% | D. | 60% |
分析 反应前X、Y的物质的量之比是1:2,设X、Y物质的量分别为1mol、2mol,达平衡时消耗X物质的量为nmol,则:
X(g)+2Y(g)?2Z(g)
起始量(mol):1 2 0
变化量(mol):n 2n 2n
平衡量(mol):1-n 2-2n 2n
平衡混合气体中反应物的总物质的量与生成物的总物质的量,据此列方程计算解答.
解答 解:反应前X、Y的物质的量之比是1:2,设X、Y物质的量分别为1mol、2mol,达平衡时消耗X物质的量为nmol,则:
X(g)+2Y(g)?2Z(g)
起始量(mol):1 2 0
变化量(mol):n 2n 2n
平衡量(mol):1-n 2-2n 2n
平衡混合气体中反应物的总物质的量与生成物的总物质的量,则1-n+2-2n=2n,解得n=0.6,
故X的转化率为$\frac{0.6mol}{1mol}$×100%=60%,
故选:D.
点评 本题考查化学平衡的有关计算,难度不大,注意三段式解题法再化学平衡计算中应用,旨在考查学生对基础知识的理解掌握.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
12.向阳中学高二某小组同学设计并进行了一系列有关Fe2+与Fe3+的相关实验.
请回答下列问题:
(1)实验一步骤(I)中Fe(OH)2Cl与盐酸反应的离子方程式是Fe(OH)2Cl+2H+=Fe3++Cl-+2H2O.
(2)实验一步骤(II)中的实验现象是溶液变为浅绿色,且有无色气体生成;加入稍过量铁粉的作用是防止亚铁离子被氧化为铁离子.
(3)实验二步骤(II)中溶液变红的原因是2H++2Fe2++H2O2=2Fe3++2H2O、Fe3++3SCN-=Fe(SCN)3(用离子方程式表示).
(4)实验二步骤(II)中生成气体的化学方程式是2H2O2$\frac{\underline{\;铁离子\;}}{\;}$2H2O+O2↑.
(5)实验三步骤(I)中的黄色液体中含有的溶质微粒除了K+、Cl-,还有Fe3+、I-、Fe2+、I2;该反应的离子方程式是2Fe3++2I-?2Fe2++I2.
(6)完成实验四步骤(I)时所用的主要玻璃仪器是分液漏斗、烧杯.
(7)已知用KSCN检验Fe3+时,Fe3+的最低显色浓度为1×10-3mol/L.实验四中最终溶液不变红的原因是碘被萃取至CCl4中,水层中的c(I2)下降,平衡2Fe3++2I-?2Fe2++I2正向移动,多次萃取后,Fe3+的浓度下降至1×10-3mol/L以下,无法显色.
| 实验序号 | 实验步骤和操作 | 实验现象 |
| 实验一 | (I)取氧化亚铁固体[已部分变质,含有少量难溶于水的杂质Fe(OH)2Cl],向其中加入过量稀盐酸. (II)再加入稍过量的铁粉,振荡. | 固体完全溶解,溶液呈黄绿色 |
| 实验二 | (I)取实验一得到的溶液,加入KSCN溶液. (II)再加入少量H2O2溶液. | 无明显实验现象 溶液变红,有少量气泡 |
| 实验三 | (I)取10mL0.1mol/LKI溶液,滴加6滴0.1mol/L FeCl3溶液.(II)取少量上述黄色液体,滴加KSCN溶液. (III)另取上述黄色液体,加入淀粉溶液. | 溶液呈黄色 溶液变红 溶液变蓝 |
| 实验四 | (I)向实验三步骤I中所得的黄色溶液中加入2mLCCl4,充分振荡后,分离得到水层:重复操作三次. (II)向实验四步骤I中所得水层中加KSCN溶液. | 上层溶液无色 下层溶液为黄色 无明显实验现象 |
(1)实验一步骤(I)中Fe(OH)2Cl与盐酸反应的离子方程式是Fe(OH)2Cl+2H+=Fe3++Cl-+2H2O.
(2)实验一步骤(II)中的实验现象是溶液变为浅绿色,且有无色气体生成;加入稍过量铁粉的作用是防止亚铁离子被氧化为铁离子.
(3)实验二步骤(II)中溶液变红的原因是2H++2Fe2++H2O2=2Fe3++2H2O、Fe3++3SCN-=Fe(SCN)3(用离子方程式表示).
(4)实验二步骤(II)中生成气体的化学方程式是2H2O2$\frac{\underline{\;铁离子\;}}{\;}$2H2O+O2↑.
(5)实验三步骤(I)中的黄色液体中含有的溶质微粒除了K+、Cl-,还有Fe3+、I-、Fe2+、I2;该反应的离子方程式是2Fe3++2I-?2Fe2++I2.
(6)完成实验四步骤(I)时所用的主要玻璃仪器是分液漏斗、烧杯.
(7)已知用KSCN检验Fe3+时,Fe3+的最低显色浓度为1×10-3mol/L.实验四中最终溶液不变红的原因是碘被萃取至CCl4中,水层中的c(I2)下降,平衡2Fe3++2I-?2Fe2++I2正向移动,多次萃取后,Fe3+的浓度下降至1×10-3mol/L以下,无法显色.
13.下列说法中,不正确的是( )
| A. | 常温下可用铁制容器盛装浓硝酸 | B. | 氧化铁常用作红色油漆和涂料 | ||
| C. | 硅胶常用作食品、药品干燥剂 | D. | 生石灰可用作食品的抗氧化剂 |
10.已知:2SO2(g)+O2(g)?2SO3(g)△H=-197kJ•mol-1.实验测得4mol SO2参加上述反应放出354kJ热量,则SO2的转化率最接近于( )
| A. | 90% | B. | 80% | C. | 50% | D. | 40% |
14.水热法制备纳米颗粒Y(化合物)的反应为:3Fe2++2S2O32-+O2+aOH-═Y+S4O62-+2H2O.下列有关该反应的说法中,不正确的是( )
| A. | a=4 | B. | 还原剂是Fe2+ | ||
| C. | 氧化剂是O2 | D. | Y的化学式为Fe3O4 |
11.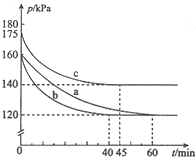 反应AX3(g)+X2(g)?AX5(g)在容积为10L的密闭容器中进行.起始时AX3和X2均为0.2mol.反应在不同条件下进行,反应体系总压强随时间的变化如图所示.下列说法正确的是( )
反应AX3(g)+X2(g)?AX5(g)在容积为10L的密闭容器中进行.起始时AX3和X2均为0.2mol.反应在不同条件下进行,反应体系总压强随时间的变化如图所示.下列说法正确的是( )
 反应AX3(g)+X2(g)?AX5(g)在容积为10L的密闭容器中进行.起始时AX3和X2均为0.2mol.反应在不同条件下进行,反应体系总压强随时间的变化如图所示.下列说法正确的是( )
反应AX3(g)+X2(g)?AX5(g)在容积为10L的密闭容器中进行.起始时AX3和X2均为0.2mol.反应在不同条件下进行,反应体系总压强随时间的变化如图所示.下列说法正确的是( )| A. | 实验a从反应开始至达到平衡时的反应速率v(AX5)=0.17 mol•L-1•min-1 | |
| B. | 实验b达到平衡时,化学平衡常数为10 | |
| C. | 实验c达到平衡时,AX3的平衡转化率为50% | |
| D. | 图中3组实验从反应开始至达到平衡时的反应速率v(AX5)由大到小的次序为b>c>a |