题目内容
19.草酸亚铁晶体(FeC2O4•2H2O)呈淡黄色.某课题组为探究草酸亚铁晶体的化学性质,进行了一系列实验探究.(1)向盛有草酸亚铁晶体的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现溶液颜色逐渐变为棕黄色,并检测到二氧化碳气体生成.这说明草酸亚铁晶体具有还原性(填“氧化性”、“还原性”或“碱性”).若反应中消耗1.5mol FeC2O4•2H2O,则参加反应的KMnO4为0.9mol.
(2)资料表明:在密闭容器中加热到一定温度时,草酸亚铁晶体可完全分解,生成几种氧化物,残留物为黑色固体.课题组根据课本上所介绍的铁的氧化物的性质,对黑色固体的组成提出如下假设,请你完成假设二和假设三:
假设一:全部是FeO 假设二:全部是Fe3O4 假设三:FeO和Fe3O4
(3)为验证上述假设一是否成立,课题组进行如下研究.
【定性研究】请你完成如表中内容.
| 实验步骤(不要求写出具体操作过程) | 预期实验现象和结论 |
| 取少量黑色固体加入足量稀盐酸(或稀硫酸)溶解, 在溶液中滴加KSCN溶液 | 若溶液不变红色,则假设一成立. 若溶液变红色,则假设一不成立 |
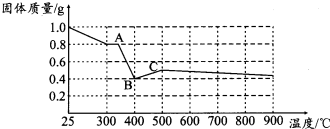
根据图象,如有1.0g草酸亚铁晶体在坩埚中敞口充分加热,最终残留黑色固体的质量大于0.4g.某同学由此得出结论:假设一不成立.你是否同意该同学的结论,并简述理由:不同意,实验未在密闭容器中进行,FeO会被空气中的氧气进一步氧化,生成的铁的其它氧化物.
分析 (1)向盛有草酸亚铁晶体的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现溶液颜色逐渐变为棕黄色,并检测到CO2生成.说明草酸亚铁被氧化为铁离子、二氧化碳气体,草酸亚铁具有还原性,依据电子守恒计算得到消耗的高锰酸钾物质的量;
(2)草酸亚铁晶体可完全分解,生成几种氧化物,残留物为黑色固体可能为氧化亚铁或四氧化三铁,分析判断;
(3)【定性研究】氧化亚铁溶解于盐酸生成氯化亚铁溶液,加入KSCN溶液,若溶液不变红证明假设一正确;
【定量研究】根据图中提供的信息,通过计算可以判断反应的化学方程式和物质的化学式;
如有1.0g草酸亚铁晶体在坩埚中敞口充分加热,最终残留黑色固体的质量大于0.4g.某同学由此得出结论:假设一不成立不合理,氧化亚铁可以被空气氧化.
解答 解:(1)向盛有草酸亚铁晶体的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现溶液颜色逐渐变为棕黄色,并检测到CO2生成.说明草酸亚铁被氧化为铁离子、二氧化碳气体,草酸亚铁具有还原性,依据电子守恒计算得到消耗的高锰酸钾物质的量,依据氧化还原反应电子守恒原子守恒配平书写离子方程式为5Fe2++5C2O42-+3MnO4-+24H+=5Fe3++3Mn2++10CO2↑+12H2O,消耗1.5mol FeC2O4•2H2O,则参加反应的KMnO4为0.9mol,
故答案为:还原性;0.9 mol;
(2)假设一:全部是氧化亚铁;假设二:全部是四氧化三铁;假设三:氧化亚铁和四氧化三铁的混合物,
故答案为:全部是四氧化三铁;氧化亚铁和四氧化三铁的混合物;
(3)【定性研究】实验步聚:取少量黑色固体,加入适量的稀盐酸(或稀硫酸)溶解,在溶液中加入KSCN溶液.现象与结论:若溶液不变红,则假设一成立,若溶液变红,则假设一不成立;
故答案为:取少量黑色固体,加入适量的稀盐酸(或稀硫酸)溶解,在溶液中加入KSCN溶液,若溶液不变红,则假设一成立,若溶液变红,则假设一不成立;
【定量研究】通过剩余固体的质量可知,过程Ⅰ发生的反应是:草酸亚铁晶体受热失去结晶水,设失去结晶水x,图象分析可知固体质量变化1.0-0.8=0.2g,依据则反应的化学方程式计算为:
FeC2O4•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$FeC2O4•(2-x)H2O+xH2O△m
180 18x
1.0 0.2 x=2
加热到300°C,晶体全部失去结晶水生成草酸亚铁和水,
继续加热到400°C,固体质量减少0.8g-0.4g=0.4g;此时草酸亚铁分解减少的是气体质量,反应过程中一定存在反应生成氧化亚铁和二氧化碳,铁元素化合价不变时,依据元素化合价变化和电子守恒可知碳元素化合价从+3价变化为+4价,一定有化合价降低生成+2价的一氧化碳,反应的化学方程式FeC2O4$\frac{\underline{\;\;△\;\;}}{\;}$FeO+CO+CO2,
FeC2O4$\frac{\underline{\;\;△\;\;}}{\;}$FeO+CO+CO2 △m
144 72
0.8 0.4
计算结果符合图象固体质量变化,所以反应的化学方程式为FeC2O4•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$FeO+CO↑+CO2↑+2H2O或FeC2O4$\frac{\underline{\;\;△\;\;}}{\;}$FeO+CO↑+CO2↑,
故答案为:FeC2O4•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$FeO+CO↑+CO2↑+2H2O或FeC2O4$\frac{\underline{\;\;△\;\;}}{\;}$FeO+CO↑+CO2↑;
如有1.0g草酸亚铁晶体在坩埚中敞口充分加热,依据铁元素守恒计算得到若生成氧化亚铁,质量为0.4g,但实验过程中最终残留黑色固体的质量大于0.4g,可能是实验未在密闭容器中进行,氧化亚铁被空气氧化为氧化铁,某同学由此得出结论:假设一不成立不合理,
故答案为:不同意,实验未在密闭容器中进行,FeO会被空气进一步氧化,生成铁的其它氧化物.
点评 本题考查了铁及其化合物性质的实验验证和实验分析判断,定量计算,图象分析是解题关键,题目难度较大.

| A. | 90% | B. | 80% | C. | 50% | D. | 40% |
| A. | a=4 | B. | 还原剂是Fe2+ | ||
| C. | 氧化剂是O2 | D. | Y的化学式为Fe3O4 |
| 选项 | 操作 | 现象 | 结论 |
| A | 向AgCl悬浊液中滴加NaI溶液 | 出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| B | 常温下将Al片放入浓硝酸中 | 无明显变化 | Al与浓硝酸不反应 |
| C | 向AgNO3溶液中滴加过量氨水 | 溶液澄清 | Ag+与NH3•H2O能大量共存 |
| D | 将水蒸气通过灼热的铁粉 | 粉末变红 | 铁与水在高温下发生反应 |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
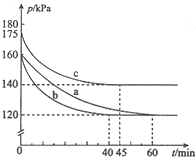 反应AX3(g)+X2(g)?AX5(g)在容积为10L的密闭容器中进行.起始时AX3和X2均为0.2mol.反应在不同条件下进行,反应体系总压强随时间的变化如图所示.下列说法正确的是( )
反应AX3(g)+X2(g)?AX5(g)在容积为10L的密闭容器中进行.起始时AX3和X2均为0.2mol.反应在不同条件下进行,反应体系总压强随时间的变化如图所示.下列说法正确的是( )| A. | 实验a从反应开始至达到平衡时的反应速率v(AX5)=0.17 mol•L-1•min-1 | |
| B. | 实验b达到平衡时,化学平衡常数为10 | |
| C. | 实验c达到平衡时,AX3的平衡转化率为50% | |
| D. | 图中3组实验从反应开始至达到平衡时的反应速率v(AX5)由大到小的次序为b>c>a |
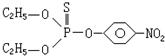 下列说法正确的是( )
下列说法正确的是( )| A. | 该有机物属于芳香烃 | B. | 该有机物易溶于水 | ||
| C. | 该有机物不能发生加成反应 | D. | 该有机物能发生取代反应 |
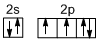 ;
;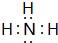 ,B的结构式为
,B的结构式为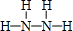 .
.