题目内容
5.如图1是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容.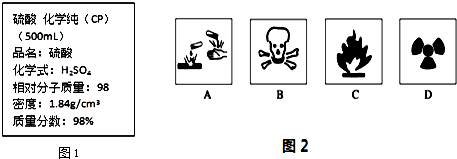
Ⅰ.(1)在盛放浓硫酸的试剂瓶的标签上应印有如图2警示标志中的A.
(2)若将该浓硫酸与等质量的水混合,则所得溶液中溶质物质的量浓度<9.2mol/L
(填>、<、=).
Ⅱ.现欲用该浓硫酸配制成1mol/L的稀硫酸,现实验室仅需要这种稀硫酸220mL.试回答下列问题:
(3)用量筒量取该浓硫酸13.6 mL.
(4)配制时,必须使用的仪器除量筒、烧杯外,还缺少的仪器是250mL容量瓶、胶头滴管、玻璃棒.
(5)若在稀释过程中,浓硫酸不慎沾在手上,处理方法为先用抹布拭去,再用大量水冲洗,最后涂上3%~5%的(或稀)NaHCO3溶液.
(6)配制溶液的过程中,其他操作都正确,下列操作会使所配溶液浓度偏高的是BCF.
A.用量筒量取浓硫酸时俯视
B.稀释浓硫酸时,未冷却到室温即转移到容量瓶中
C.量取浓H2SO4后的量筒进行洗涤,并将洗涤液转移到容量瓶中
D.定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至凹液面最低处与刻度线相切
E.容量瓶不干燥
F.定容时,俯视容量瓶刻度线.
分析 Ⅰ.(1)浓硫酸具有强烈的腐蚀性;
(2)根据c=$\frac{1000ρω}{M}$计算,注意硫酸的浓度越大,密度越大,以此判断浓度大小关系.
Ⅱ.(3)根据c=$\frac{1000ρω}{M}$计算浓H2SO4的物质的量浓度,再根据溶液稀释前后物质的量不变计算所需浓硫酸的体积;
(4)根据配制一定物质的量浓度的溶液的配制步骤选择使用的仪器;
(5)先用抹布拭去,再用大量水冲洗;
(6)根据实验操作对c=$\frac{n}{V}$的影响判断各选项对配制的溶液浓度的影响.
解答 解:Ⅰ.(1)浓硫酸具有强烈的腐蚀性,所以应标签上应印有腐蚀品标志,故选:A;
(2)根据c=$\frac{1000ρω}{M}$计算,设98%的浓H2SO4的密度为x,49%的H2SO4溶液的密度为y,物质的量浓度为c,
则:$\frac{1000x×98%}{98}$=18.4,$\frac{1000y×49%}{98}$=c
所以:$\frac{2x}{y}$=$\frac{18.4}{c}$,因硫酸的浓度越大,密度越大,则x>y,
则:c<9.2mol/L,
故答案为:<;
Ⅱ.(3)浓H2SO4的物质的量浓度c=$\frac{1000×1.84×98%}{98}$mol/L=18.4mol/L;
根据稀释定律,稀释前后溶质的物质的量不变,来计算浓硫酸的体积,设浓硫酸的体积为xmL,则有:
xmL×18.4mol/L=250mL×1mol/L,解得:x≈13.6;
故答案为:13.6;
(4)操作步骤有计算、量取、稀释、移液、洗涤移液、定容、摇匀等操作,用量筒量取(用到胶头滴管)浓硫酸,在烧杯中稀释,用玻璃棒搅拌,冷却后转移到容量瓶中,并用玻璃棒引流,洗涤2-3次,将洗涤液转移到容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.由提供的仪器可知还需要仪器有250mL容量瓶、胶头滴管、玻璃棒,
故答案为:250mL容量瓶、胶头滴管、玻璃棒;
(5)若在稀释过程中,浓硫酸不慎沾在手上,处理方法为 先用布擦,再用大量水冲洗、最后涂上3%~5%的NaHCO3溶液,故答案为:先用抹布拭去,再用大量水冲洗,最后涂上3%~5%的(或稀)NaHCO3溶液;
(6)A.量取浓硫酸时,俯视读数,导致量取的浓硫酸体积偏小,配制的溶液中溶质的物质的量偏小,溶液浓度偏低;
B.稀释浓硫酸时,未冷却到室温即转移到容量瓶中,导致配制溶液体积偏小,溶液浓度偏高;
C.洗涤量取浓H2SO4后的量筒,并将洗涤液转移到容量瓶中,导致配制的溶液中溶质的物质的量偏大,溶液浓度偏高;
D.定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至凹液面最低处与刻度线相切,导致配制的溶液体积偏大,配制的溶液浓度偏低;
E.容量瓶不干燥,由于定容还需要加入蒸馏水,所以不影响配制结果;
F.定容时,俯视容量瓶刻度线,导致配制溶液体积偏小,溶液浓度偏高;
故答案为:BCF.
点评 本题考查了配制一定物质的量浓度的溶液方法及误差分析,题目难度不大,注意掌握配制一定物质的量浓度的溶液的配制步骤及误差分析方法,试题有利于培养学生的分析、理解能力及灵活应用所学知识的能力.

 春雨教育同步作文系列答案
春雨教育同步作文系列答案 我国科学家最新研发的固体透氧膜提取金属钛工艺,其电解装置如图所示:将TiO2熔于NaCl-NaF融盐体系,以石墨为阴极,覆盖氧渗透膜的多孔金属陶瓷涂层为阳极,固体透氧膜把阳极和熔融电解质隔开,只有O2-可以通过.下列说法不正确的是( )
我国科学家最新研发的固体透氧膜提取金属钛工艺,其电解装置如图所示:将TiO2熔于NaCl-NaF融盐体系,以石墨为阴极,覆盖氧渗透膜的多孔金属陶瓷涂层为阳极,固体透氧膜把阳极和熔融电解质隔开,只有O2-可以通过.下列说法不正确的是( )| A. | a 极是电源的正极,O2-在熔融盐中从右往左迁移 | |
| B. | 阳极电极反应式为2O2--4e-=O2↑ | |
| C. | 阳极每产生4.48L的O2,理论上能生成0.2mol钛 | |
| D. | NaCl-NaF融盐的作用是降低熔化TiO2需要的温度 |
| A. | 铁跟盐酸的反应 Fe+2H+═Fe3++H2↑ | |
| B. | 铁片和CuSO4溶液的反应 2Fe+3Cu2+═3Cu+2Fe3+ | |
| C. | 钠与跟水反应 Na+H2O═Na++OH-+H2↑ | |
| D. | 氯化铁溶液和氢氧化钠溶液的反应Fe3++3OH-═Fe(OH)3↓ |
| A. | 常温下可用铁制容器盛装浓硝酸 | B. | 氧化铁常用作红色油漆和涂料 | ||
| C. | 硅胶常用作食品、药品干燥剂 | D. | 生石灰可用作食品的抗氧化剂 |
| A. | 离子晶体中每个离子周围均吸引着6个带相反电荷的离子 | |
| B. | 原子晶体中的各相邻原子都以共价键相结合 | |
| C. | 合金的熔沸点高于成分金属,硬度大于成分金属 | |
| D. | 金属导电的原因是在外电场作用下金属产生自由电子,电子定向运动 |
| A. | 90% | B. | 80% | C. | 50% | D. | 40% |
| A. | a=4 | B. | 还原剂是Fe2+ | ||
| C. | 氧化剂是O2 | D. | Y的化学式为Fe3O4 |