��Ŀ����
����Ŀ��������أ�K2FeO4����һ�ָ�Ч��ˮ������֪��K2FeO4������ˮ������ŨKOH��Һ�������Ի�������Һ�в��ȶ�����0��5����ǿ������Һ�н��ȶ���ijʵ��С�����Ʊ�������ز��ⶨ�䴿�ȡ�
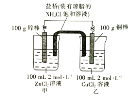
��.�Ʊ�������أ��г�װ���ԣ�
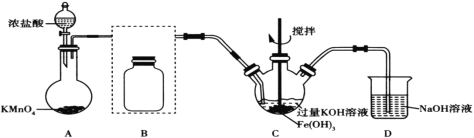
��1��װ��AΪ��������װ�ã�����ʢ�Ÿ�����ص���������Ϊ__��
��2��������װ��B�������������������Լ�__��
��3��װ��C��Cl2��Fe(OH)3��KOH��Ӧ����K2FeO4�Ļ�ѧ����ʽ��____��
��4��ʵ��ʱ��װ��C���ڱ�ˮԡ�У���ԭ����____��
��5��ʵ��ᾧ���õ���K2FeO4�����Ժ��϶����ʣ�Ҫ�õ������ľ��壬��Ӧ��ȡ�IJ���������____��
��.�ⶨ��Ʒ����
��6����wg K2FeO4�ֲ�Ʒ���ڹ����ļ����Ǹ�������Һ�У���ַ�Ӧ����ϡ�����ữ��pHΪ2�������õ��ظ�������Һ�м���5�ζ�������������Һ��ָʾ����Ȼ����c mol��L1(NH4)2Fe(SO4)2����Һ�ζ����յ㣬���ı���ҺVmL����֪�ù������漰�����ӷ�Ӧ��Ҫ��������
��Cr(OH)4+ FeO42-=Fe(OH)3��+CrO42-+OH��
��_______��
��Cr2O72-+6Fe2++ 14H+=6Fe3+ +2Cr3+ +7H2O��
�ôֲ�Ʒ��K2FeO4����������Ϊ__���ú�w��c��V�Ĵ���ʽ��ʾ�������ζ���û���ñ�Һ��ϴ�����õĽ��__���ƫ�ߡ���ƫ�͡�����Ӱ�족����
���𰸡�Բ����ƿ 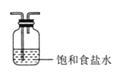 3Cl2��2Fe(OH)3��10KOH=2K2FeO4��6KCl��8H2O K2FeO4��0��5�滷���н��ȶ�����ֹ����Ӧ���� �ؽᾧ 2CrO42����2H��
3Cl2��2Fe(OH)3��10KOH=2K2FeO4��6KCl��8H2O K2FeO4��0��5�滷���н��ȶ�����ֹ����Ӧ���� �ؽᾧ 2CrO42����2H��![]() Cr2O72����H2O
Cr2O72����H2O ![]() ��
��![]() ��
��![]() ƫ��
ƫ��
��������
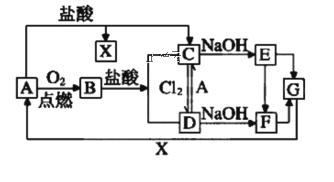
������Ũ�����KMnO4�Ʊ�Cl2���Ʊ���Cl2������HCl����Ҫ�ñ���ʳ��ˮ���ӣ�Cl2��Fe(OH)3��KOH��Ӧ����K2FeO4������NaOH��Һ���������Cl2��
(1)���������Ľṹ����֪������ΪԲ����ƿ��
(2)װ��B�������dz�ȥCl2�е�HCl��ѡ�ñ���ʳ��ˮ��װ����ͼ��ʾ ��
��
(3)Cl2��Cl�Ļ��ϼ۽��ͣ���0���͵���1��������2�ۣ�Fe(OH)3��Fe�Ļ��ϼ����ߣ��ӣ�3���ߵ���6�����ϼ������غ㣬��Cl2��Fe(OH)3��ϵ����Ϊ3��2���ٸ���ԭ���غ���ƽ����ѧ����ʽΪ3Cl2��2Fe(OH)3��10KOH=2K2FeO4��6KCl��8H2O��
(4)����K2FeO4��0��5����ǿ������Һ�н��ȶ�����˽�װ��C���ڱ�ˮԡ����K2FeO4��0��5�������н��ȶ�����ֹ����Ӧ������
(5)K2FeO4������ˮ�У��ᾧ���K2FeO4�к��н϶����ʣ����������ؽᾧ�ᴿ��
��(6)���ݷ�Ӧ�ٺۣ͢�����H2SO4�ữ��Ӧ���еIJ���CrO42��ת��ΪCr2O72�������ӷ���Ϊ2CrO42����2H��Cr2O72����H2O��
���ݷ�Ӧ����ʽ���ɵù�ϵʽK2FeO4��CrO42����![]() Cr2O72����3Fe2����n(K2FeO4)=
Cr2O72����3Fe2����n(K2FeO4)=![]() n[(NH4)2Fe(SO4)2]=
n[(NH4)2Fe(SO4)2]=![]() ��cV��10��3mol��m(K2FeO4)=
��cV��10��3mol��m(K2FeO4)=![]() ��cV��10��3mol��198g��mol��1=0.066cVg����K2FeO4����������Ϊ
��cV��10��3mol��198g��mol��1=0.066cVg����K2FeO4����������Ϊ![]() ��
��
����ζ���û���ñ�Һ��ϴ����ô���ĵı�Һ����������ӣ�����õ�K2FeO4�����������ӣ���������ƫ�ߡ�

����Ŀ����Ҫ��ش��������⣺
��1�������������ʣ���NaCl���� ��Һ̬HCl ��CaCO3���� ������KCl ������ ��ͭ ��CO2 ��H2SO4 ��KOH����
a. �����������ܵ������________________________________��
b. �������������ڵ���ʵ���_______________________�����ڷǵ���ʵ���_______________________��
c. ���������У�����ˮ���ܵ����������_______________________��
��2���������Һ�ı���������________________�����������Һ�����õķ����ǹ۲��Ƿ��ܷ���___________ЧӦ��
��3������3����Ӧ����Ҫ����д�������
��2Na2O2+2H2O��4NaOH+ O2����Ӧ�У�ÿ����1 mol Na2O2����_____ g O2��
����NaHCO3���ȷֽⷴӦ�У�ÿ����168 g NaHCO3����״��������_____L CO2��
��Cl2+H2O��HCl+HClO��Ӧ�У���״����ÿ����22.4LCl2��ת��_____mol���ӡ�
��4����һ���ܱ������з��������������ʣ���һ�������·�����ѧ��Ӧ��һ��ʱ�����й��������£�
���� | M | N | Q | P |
��Ӧǰ������g�� | 50 | 1 | 3 | 12 |
��Ӧ��������g�� | x | 26 | 3 | 30 |
�ٸñ仯�Ļ�����Ӧ������_____��Ӧ��
������Q�ڷ�Ӧ�����������_____��