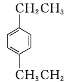
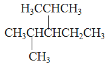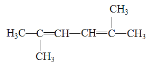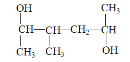题目内容
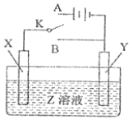
【题目】已知A是一种常见的一种金属,F是一种红褐色的沉淀。试根据图中转化关系,回答下列问题。
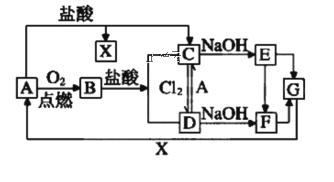
(1)写出A、B、D、E的化学式:A___、B___、D___、E___。
(2)检验D中阳离子的方法:___。
(3)保存C溶液时为什么加固体A___。
(4)写出下列转化的离子方程式
①C→E___。
②A→C___。
【答案】Fe Fe3O4 FeCl3 Fe(OH)2 取该溶液少许于试管中,滴加几滴KSCN溶液,溶液显血红色,则证明溶液有三价铁离子,否则没有 防止Fe2+被氧化 Fe2++2OH-=Fe(OH)2↓ Fe+2H+=Fe2++H2↑
【解析】
F是一种红褐色的沉淀,则其为Fe(OH)3,A为Fe。从而可推出B为Fe3O4,C为FeCl2,D为FeCl3,E为Fe(OH)2,F为Fe(OH)3,G为Fe2O3,X为HCl。
(1)由以上推断,可确定A、B、D、E的化学式。
(2)D中阳离子为Fe3+,检验的方法是使用KSCN溶液。
(3)C为FeCl2,保存溶液时,需防止Fe2+被空气中的O2氧化。
(4)①C→E,是FeCl2与NaOH发生反应。
②A→C,是Fe与HCl发生反应。
F是一种红褐色的沉淀,则其为Fe(OH)3,A为Fe。从而可推出B为Fe3O4,C为FeCl2,D为FeCl3,E为Fe(OH)2,F为Fe(OH)3,G为Fe2O3,X为HCl。
(1)由以上推断,可确定A为 Fe、B为 Fe3O4、D为 FeCl3、E为 Fe(OH)2。答案为:Fe;Fe3O4;FeCl3;Fe(OH)2;
(2)D中阳离子为Fe3+,检验的方法是取该溶液少许于试管中,滴加几滴KSCN溶液,溶液显血红色,则证明溶液有三价铁离子,否则没有。答案为:取该溶液少许于试管中,滴加几滴KSCN溶液,溶液显血红色,则证明溶液有三价铁离子,否则没有;
(3)C为FeCl2,保存溶液时,需防止Fe2+被空气中的O2氧化。答案为:防止Fe2+被氧化;
(4)①C→E,离子方程式为Fe2++2OH-=Fe(OH)2↓。答案为:Fe2++2OH-=Fe(OH)2↓;
②A→C,离子方程式为Fe+2H+=Fe2++H2↑。答案为:Fe+2H+=Fe2++H2↑。

【题目】由CH3CH2CH2Br制备CH3CH(OH)CH2OH,依次发生的反应类型和反应条件都正确的是
选项 | 反应类型 | 反应条件 |
A | 加成、取代、消去 | KOH醇溶液/加热、KOH水溶液/加热、常温 |
B | 消去、加成、取代 | NaOH醇溶液/加热、常温、KOH水溶液/加热 |
C | 氧化、取代、消去 | 加热、KOH醇溶液/加热、KOH水溶液/加热 |
D | 消去、加成、水解 | NaOH水溶液/加热、常温、NaOH醇溶液/加热 |
A. A B. B C. C D. D