题目内容
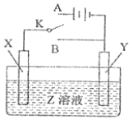
【题目】某化学兴趣小组的同学设计了如图所示的装置,完成下列问题:
(1)反应过程中,______棒质量增加。
(2)总反应的离子方程式为_____。
(3)反应中,当其中一个电极质量变为102g时,另一电极质量______________(填大于、小于或等于)98g。
(4)反应过程中,盐桥中的________ 离子进入甲杯。
(5)当外电路中转移0.2mol电子时,乙烧杯中浓度最大的阳离子是_________,其物质的量浓度为_______________。(假设溶液体积不变)
【答案】铜 Zn+Cu2+=Zn2++Cu 小于 Cl- NH4+ 2mol/L
【解析】
该装置为原电池装置,Zn棒为负极,发生Zn-2e-=Zn2+,Cu为正极,发生Cu2++2e-=Cu。
(1)反应中,Cu棒作正极,发生Cu2++2e-=Cu,质量增加;
(2)Zn作负极,发生Zn-2e-=Zn2+,则总离子方程式为Zn+Cu2+=Zn2++Cu;
(3)电极质量增加的一极为Cu棒,增加2g时,转移电子为![]() ×2mol,则Zn减少的质量为
×2mol,则Zn减少的质量为![]() ×65g>2g,则剩余质量小于98g;
×65g>2g,则剩余质量小于98g;
(4)电池的内电路中,阳离子向正极移动,阴离子向负极移动,盐桥中氯离子移向甲杯;
(5)当外电路中转移0.2mol电子时,乙溶液中Cu2+减少为0.1mol,NH4+增加0.2mol,则乙中阳离子最多的为NH4+,其浓度=0.2mol/0.2L=2mol/L。

练习册系列答案
 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案
相关题目