题目内容
2.下列离子方程式正确的是( )| A. | 向FeBr2溶液中通入少量Cl2:Cl2+2Br-═2Cl-+Br2 | |
| B. | 除去MgCl2溶液中少量的FeCl3:3Mg+2Fe3+═2Fe+3Mg2+ | |
| C. | 向含有氨水的BaCl2溶液中通入SO2:SO2+2NH3•H2O+Ba2+═BaSO3↓+2NH4++H2O | |
| D. | 将少量二氧化碳通入氯化钙溶液中:Ca2++CO2+H2O═CaCO3+2H+ |
分析 A.通入少量Cl2,只氧化亚铁离子;
B.除去MgCl2溶液中少量的FeCl3,应加MgO或氢氧化镁等促进铁离子的水解;
C.反应生成亚硫酸钡、氯化铵和水;
D.少量二氧化碳通入氯化钙溶液不反应.
解答 解:A.亚铁离子还原性大于溴离子,向溶液中通入少量,氯气先氧化亚铁离子,向FeBr2溶液中通入少量Cl2的离子反应为Cl2+2Fe2+═2Cl-+2Fe3+,故A错误;
B.镁不能从氯化铁溶液中置换出铁单质,应加MgO或氢氧化镁等促进铁离子的水解,故B错误;
C.向含有氨水的BaCl2溶液中通入SO2时,SO2首先与NH3•H2O反应生成(NH4)2SO3,生成的再与Ba2+反应生成BaSO3沉淀,离子反应为SO2+2NH3•H2O+Ba2+═BaSO3↓+2NH4++H2O,故C正确;
D.碳酸酸性小于盐酸,二氧化碳不能与氯化钙溶液反应生成碳酸钙和盐酸,故D错误;
故选C.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重对氧化还原反应规律、盐的水解、强酸制弱酸反应规律的理解的考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.

练习册系列答案
相关题目
13.汽车尾气中二氧化硫、氮氧化物和可吸入颗粒物是雾霾主要组成.某课题组用汽车尾气为原料探究二氧化硫、氮氧化物的化学性质.
I.汽车尾气(含有烃类、CO、SO2与NO等物质),冶理的方法之一是在汽车的排气管上装一个“催化转换器”(用铂、钯合金作催化剂).它的特点是使CO与NO反应,生成可参与大气生态环境循环的无毒气体,并促使烃类充分燃烧及SO2的转化.写出一氧化碳与一氧化氮反应的化学方程式:2CO+2NO?2CO2+N2
Ⅱ.课题组欲在绿色环保的条件下探究大气污染物SO2的性质,设计如图实验装置.请回答:
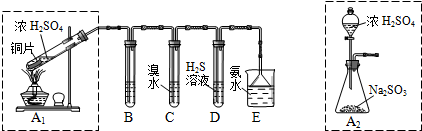
(1)B、C、D分别用于检验SO2的漂白性、还原性和氧化性,则B中所盛试剂为品红溶液;
C中反应的离子方程式为SO2+Br2+2H2O═SO42-+2Br-+4H+.
(2)为了实现绿色环保的目标,制取SO2装置最好选择A2.(A1或A2装置)用氨水吸收尾气中的SO2,“吸收液”中可能含有OH-、SO32-、SO42-、HSO3-等阴离子.请回答:
(3)氨水吸收过量SO2的反应的离子方程式为NH3•H2O+SO2=NH4++HSO3-.
(4))已知亚硫酸氢盐一般易溶于水,SO2也易溶于水.现有仪器和试剂为:小烧杯、试管、玻璃棒、胶头滴管、过滤装置和滤纸;2mol/L盐酸、2mol/LHNO3、1mol/LBaCl2溶液、l mol/LBa(OH)2溶液、品红溶液、蒸馏水.请设计实验证明“吸收液”中存在SO32-、HSO3-,完成下表的实验操作、预期现象和结论:
I.汽车尾气(含有烃类、CO、SO2与NO等物质),冶理的方法之一是在汽车的排气管上装一个“催化转换器”(用铂、钯合金作催化剂).它的特点是使CO与NO反应,生成可参与大气生态环境循环的无毒气体,并促使烃类充分燃烧及SO2的转化.写出一氧化碳与一氧化氮反应的化学方程式:2CO+2NO?2CO2+N2
Ⅱ.课题组欲在绿色环保的条件下探究大气污染物SO2的性质,设计如图实验装置.请回答:

(1)B、C、D分别用于检验SO2的漂白性、还原性和氧化性,则B中所盛试剂为品红溶液;
C中反应的离子方程式为SO2+Br2+2H2O═SO42-+2Br-+4H+.
(2)为了实现绿色环保的目标,制取SO2装置最好选择A2.(A1或A2装置)用氨水吸收尾气中的SO2,“吸收液”中可能含有OH-、SO32-、SO42-、HSO3-等阴离子.请回答:
(3)氨水吸收过量SO2的反应的离子方程式为NH3•H2O+SO2=NH4++HSO3-.
(4))已知亚硫酸氢盐一般易溶于水,SO2也易溶于水.现有仪器和试剂为:小烧杯、试管、玻璃棒、胶头滴管、过滤装置和滤纸;2mol/L盐酸、2mol/LHNO3、1mol/LBaCl2溶液、l mol/LBa(OH)2溶液、品红溶液、蒸馏水.请设计实验证明“吸收液”中存在SO32-、HSO3-,完成下表的实验操作、预期现象和结论:
| 实验操作 | 预期现象与结论 |
| 步骤1:取适量“吸收液”于小烧杯中,用胶头滴管取l mol/L BaCl2溶液向小烧杯滴加直至过量. | 若出现白色浑浊,则溶液中存在SO32-或 SO42-. |
| 步骤2:将小烧杯中的浊液过滤、洗涤,再用适量水把附在滤纸上的固体冲入另一小烧杯中;向冲下的固体滴入1滴品红,再滴入过量2 mol/L盐酸,振荡 用试管取适量滤液,向其中滴入过量l mol/LBa(OH)2溶液(或1滴品红,再滴入2-3滴2 mol/L盐酸),振荡. 步骤3: | 若品红褪色(或有气泡)则存在SO32- 若出现白色沉淀(或品红褪色或有气泡),则存在HSO3- |
14.下列哪种物质所含原子数与0.2molH3PO4所含原子数相等( )
| A. | 0.4molH2O | B. | 0.2mol H2SO4 | C. | 0.8molHCl | D. | 0.3molHNO3 |
10.NA代表阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 1L lmol•L-1 FeBr2溶液与lmol氯气反应时转移的电子数为3NA | |
| B. | 0.5 mol•L-1硫酸钠溶液中含有溶质离子总数为1.5NA | |
| C. | 1mol硫酸氢钠固体中含阳离子总数NA | |
| D. | 28g由乙烯和聚乙烯组成的混合气体中含有碳碳双键数为NA |
7.化学无处不在,下列与化学有关的说法正确的是( )
| A. | Si有良好的半导体性能,可直接用于制备光导纤维 | |
| B. | 淀粉、纤维素、蛋白质、油脂都是天然高分子化合物 | |
| C. | 用食醋可除去热水壶内壁的水垢 | |
| D. | Cu的金属活泼性比Fe弱,故水库铁闸门上接装铜块可减缓铁腐蚀 |
14.能正确表示下列反应的离子方程式是( )
| A. | 稀硫酸中加入铜粉:Cu+2H+═Cu2++H2↑ | |
| B. | 用FeCl3溶液刻蚀铜制印刷电路板:Cu+Fe3+═Cu2++Fe2+ | |
| C. | 向氢氧化钠溶液中通入过量CO2:CO2+2OH-═CO32-+H2O | |
| D. | 硫酸铝溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ |
10.下列电离方程式中,错误的是( )
| A. | H2CO3?H++HCO3-; HCO3-?H++CO32- | B. | H2SO4═2H++SO42- | ||
| C. | NaHS═Na++H++S2- | D. | CH3COOH?H++CH3COO- |
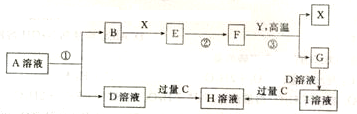
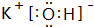 ,H的化学式为KHCO3;
,H的化学式为KHCO3;
 ;
; ;
; CH2CH2OOCH、
CH2CH2OOCH、 COOCH2CH3、
COOCH2CH3、 CH2COOCH3、
CH2COOCH3、 00CCH2CH3.
00CCH2CH3.