题目内容
13.汽车尾气中二氧化硫、氮氧化物和可吸入颗粒物是雾霾主要组成.某课题组用汽车尾气为原料探究二氧化硫、氮氧化物的化学性质.I.汽车尾气(含有烃类、CO、SO2与NO等物质),冶理的方法之一是在汽车的排气管上装一个“催化转换器”(用铂、钯合金作催化剂).它的特点是使CO与NO反应,生成可参与大气生态环境循环的无毒气体,并促使烃类充分燃烧及SO2的转化.写出一氧化碳与一氧化氮反应的化学方程式:2CO+2NO?2CO2+N2
Ⅱ.课题组欲在绿色环保的条件下探究大气污染物SO2的性质,设计如图实验装置.请回答:
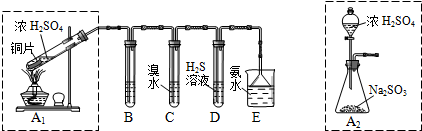
(1)B、C、D分别用于检验SO2的漂白性、还原性和氧化性,则B中所盛试剂为品红溶液;
C中反应的离子方程式为SO2+Br2+2H2O═SO42-+2Br-+4H+.
(2)为了实现绿色环保的目标,制取SO2装置最好选择A2.(A1或A2装置)用氨水吸收尾气中的SO2,“吸收液”中可能含有OH-、SO32-、SO42-、HSO3-等阴离子.请回答:
(3)氨水吸收过量SO2的反应的离子方程式为NH3•H2O+SO2=NH4++HSO3-.
(4))已知亚硫酸氢盐一般易溶于水,SO2也易溶于水.现有仪器和试剂为:小烧杯、试管、玻璃棒、胶头滴管、过滤装置和滤纸;2mol/L盐酸、2mol/LHNO3、1mol/LBaCl2溶液、l mol/LBa(OH)2溶液、品红溶液、蒸馏水.请设计实验证明“吸收液”中存在SO32-、HSO3-,完成下表的实验操作、预期现象和结论:
| 实验操作 | 预期现象与结论 |
| 步骤1:取适量“吸收液”于小烧杯中,用胶头滴管取l mol/L BaCl2溶液向小烧杯滴加直至过量. | 若出现白色浑浊,则溶液中存在SO32-或 SO42-. |
| 步骤2:将小烧杯中的浊液过滤、洗涤,再用适量水把附在滤纸上的固体冲入另一小烧杯中;向冲下的固体滴入1滴品红,再滴入过量2 mol/L盐酸,振荡 用试管取适量滤液,向其中滴入过量l mol/LBa(OH)2溶液(或1滴品红,再滴入2-3滴2 mol/L盐酸),振荡. 步骤3: | 若品红褪色(或有气泡)则存在SO32- 若出现白色沉淀(或品红褪色或有气泡),则存在HSO3- |
分析 I.依据题意一氧化碳与一氧化氮反应生成可参与大气生态环境循环的无毒气体,可知产物为氮气和二氧化碳,据此写出方程式;
II.(1)铜和浓硫酸加热反应生成二氧化硫气体,B、C、D分别用于检验SO2的漂白性、还原性和氧化性.其中C、D分别为碘水和硫化氢的水溶液,检验二氧化硫漂白性可以通过品红试液;二氧化硫具有还原性,和碘单质反应生成硫酸和碘化氢;
(2)A2的制取装置来代替A1装置,可以不需要加热或节约能源或药品,用分液漏斗加入硫酸可以控制反应速率,易于控制反应进行;
(3)过量二氧化硫和氨水反应生成亚硫酸氢铵;
(4)依据SO32-和HSO3-离子的性质和检验方法设计实验进行检验设计;结合题干信息和条件,取少量于小烧杯中加入过量氯化钡反应生成沉淀为亚硫酸钡或硫酸钡沉淀;取沉淀加入酸的生成二氧化硫,通过检验二氧化硫的存在方法验证亚硫酸根离子的存在;取滤液依据亚硫酸氢根离子和酸反应可以生成二氧化硫,检验二氧化硫完成实验设计,或通过亚硫酸氢根离子和氢氧化钡反应生成沉淀分析判断.
解答 解:I.一氧化碳与一氧化氮在催化剂的作用下反应生成二氧化碳和氮气,方程式:2CO+2NO?2CO2+N2,故答案为:2CO+2NO?2CO2+N2;
II.(1)依据装置图可知,铜和浓硫酸加热反应生成二氧化硫气体,B、C、D分别用于检验SO2的漂白性、还原性和氧化性.其中C、D分别为碘水和硫化氢的水溶液,C检验二氧化硫的还原性,D检验二氧化硫的氧化性,检验二氧化硫漂白性可以通过品红试液,品红褪色是二氧化硫气体的特性;二氧化硫具有还原性,和碘单质反应生成硫酸和碘化氢;反应的两种方程式为:SO2+I2+2H2O═SO42-+2I-+4H+;
故答案为:品红溶液; SO2+I2+2H2O═SO42-+2I-+4H+;
(2)装置图分析可知,A2的制取装置来代替A1装置,可以不需要加热或节约能源或药品,用分液漏斗加入硫酸可以控制反应速率,易于控制反应进行;或反应更充分,
故答案为:A2;
(3)氨水吸收过量SO2的反应的离子方程式为NH3•H2O+SO2═NH4++HSO3-;
故答案为:NH3•H2O+SO2═NH4++HSO3-;
(4)依据SO32-和HSO3-离子的性质和检验方法设计实验进行检验设计;结合题干信息和条件,取少量于小烧杯中加入过量氯化钡反应生成沉淀为亚硫酸钡或硫酸钡沉淀;取沉淀加入酸的生成二氧化硫,通过检验二氧化硫的存在方法验证亚硫酸根离子的存在;取滤液依据亚硫酸氢根离子和酸反应可以生成二氧化硫,检验二氧化硫完成实验设计,或通过亚硫酸氢根离子和氢氧化钡反应生成沉淀分析判断;实验设计方法和步骤为:
| 实验操作 | 预期现象与结论 |
| 步骤2:滴入1滴品红,再滴入过量2 mol/L盐酸,振荡 | 若品红褪色(或有气泡)则存在SO32- |
| 步骤3:用试管取适量滤液,向其中滴入过量l mol/LBa(OH)2溶液(或1滴品红,再滴入2-3滴2 mol/L盐酸),振荡 | 若出现白色沉淀(或品红褪色或有气泡),则存在HSO3- |
| 实验操作 | 预期现象与结论 |
| 步骤2:滴入1滴品红,再滴入过量2 mol/L盐酸,振荡 | 若品红褪色(或有气泡)则存在SO32- |
| 步骤3:用试管取适量滤液,向其中滴入过量l mol/LBa(OH)2溶液(或1滴品红,再滴入2-3滴2 mol/L盐酸),振荡 | 若出现白色沉淀(或品红褪色或有气泡),则存在HSO3- |
点评 本题考查了二氧化硫性质的实验验证方法和实验设计分析步骤,掌握实验基础和离子性质、离子检验方法,正确选择试剂,描述反应现象,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 1倍 | B. | 3倍 | C. | 5倍 | D. | 7倍 |
| A. | CH4分子的比例模型: | B. | 2-甲基-1,3-丁二烯的键线式  | ||
| C. | 乙炔分子的电子式:H:C┇┇C:H | D. | 乙烯的结构简式:CH2CH2 |
①氯化铁 ②碳酸钠 ③硫酸亚铁 ④硅酸钠.
| A. | 仅①③ | B. | 仅②④ | C. | 仅①③④ | D. | 仅①②③ |
| A. | lmol OH一中含有9 NA个电子 | |
| B. | 46g NO2和N2O4混合物中所含原子数目为3NA | |
| C. | 常温常压下50g 46%的乙醇溶液中,所含氧原子数目为0.5NA | |
| D. | .常温下,56g铁粉与足量浓硝酸反应,电子转移数目小于3NA |
| A. | 在pH=0的溶液中:Fe2+、Mg2+、SO42-、NO3- | |
| B. | 能使淀粉碘化钾试纸显蓝色的溶液:K+、SO42-、S2-、SO32- | |
| C. | 常温下c(H+)/c(OH-)=1012的溶液:Fe3+、Mg2+、NO3-、Cl- | |
| D. | 不能使酚酞变红的无色溶液:Na+、CO32-、K+、ClO-、AlO2- |
| A. | Ba(OH)2溶液中滴加NaHSO4溶液至中性:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| B. | 钠与水反应:Na+2H2O=Na++2OH-+H2↑ | |
| C. | 用氯化铁溶液和沸水反应制取氢氧化铁胶体:Fe3++3H2O(沸水)═Fe(OH)3↓+3H+ | |
| D. | 漂白粉溶液在空气中失效:ClO-+CO2+H2O═HClO+HCO3- |
| A. | 向FeBr2溶液中通入少量Cl2:Cl2+2Br-═2Cl-+Br2 | |
| B. | 除去MgCl2溶液中少量的FeCl3:3Mg+2Fe3+═2Fe+3Mg2+ | |
| C. | 向含有氨水的BaCl2溶液中通入SO2:SO2+2NH3•H2O+Ba2+═BaSO3↓+2NH4++H2O | |
| D. | 将少量二氧化碳通入氯化钙溶液中:Ca2++CO2+H2O═CaCO3+2H+ |