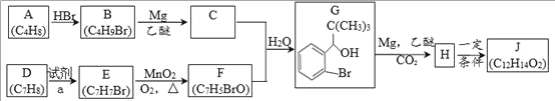
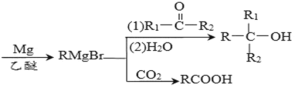
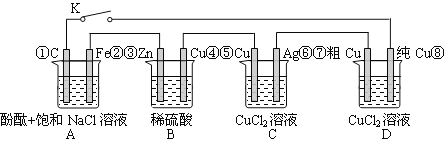
题目内容
【题目】设NA表示阿伏加德罗常数的值,下列结论中正确的是( )
A.25℃时,pH=13的Ba(OH)2溶液中含有的OH-数目为0.1NA
B.粗铜精炼时,当阳极质量减少6.4g时,电路中转移电子数一定不是0.2NA
C.含0.2molH2SO4的浓硫酸与足量铜反应,生成SO2的分子数为0.1NA
D.200mL0.5mol/LNa2CO3溶液中,由于CO32-水解,所以阴离子数目小于0.1NA
【答案】B
【解析】
A.只有溶液的浓度,没有溶液的体积,因此不能确定微粒的数目,A不正确;
B.粗铜精炼时,当阳极质量减少6.4g时,若只有铜溶解,则电路中转移电子数是0.2NA,由于粗铜中的活泼性比铜强的杂质也能溶解,因此电路中转移电子数一定不是0.2NA,B正确;
C.含0.2molH2SO4的浓硫酸与足量铜反应,若硫酸完全反应生成SO2的分子数为0.1NA;但是随着反应的进行,硫酸变为稀硫酸,反应就不再发生,故反应产生SO2的物质的量小于0.1mol,转移电子数小于0.1NA,错误;
D.200mL0.5mol/LNa2CO3溶液中,CO32-发生水解反应:CO32-+H2O![]() HCO3-+OH-,HCO3-+H2O
HCO3-+OH-,HCO3-+H2O![]() H2CO3-+OH-,可见由于CO32-水解,所以阴离子数目大于0.1NA,错误。
H2CO3-+OH-,可见由于CO32-水解,所以阴离子数目大于0.1NA,错误。
故选B。

【题目】经最新研究发现,NOx和SOx是形成雾霾天气的主要原因之一,因此研究NOx、SOx等大气污染物的妥善处理具有重要意义。
(1)为了消除NO造成的污染,通常采用一氧化碳和氢气进行催化还原NO。
已知:①N2(g)+O2(g)=2NO(g) ΔH=akJmol-1;
②2H2(g)+O2(g)=2H2O(l) ΔH=bkJmol-1;
③H2O(g)=H2O(l) ΔH=ckJmol-1。
写出H2与NO反应生成N2和水蒸气的热化学方程式:________________________。
(2)目前应用最广泛的烟气氮氧化物脱除技术是NH3催化还原氮氧化物(SCR)技术。反应原理如图所示:
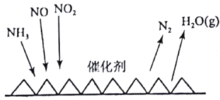
当NO2与NO的物质的量之比为1:1时,与足量氨气在一定条件下发生反应。当有12mol电子发生转移时,则参与反应的NO2的物质的量为________。
(3)T1温度时在容积为2L的恒容密闭容器中发生反应:2NO(g)+O2(g)![]() 2NO2(g) ΔH<0。实验测得:v正=v消耗(NO)=2v消耗(O2)=k正c2(NO)c(O2),v逆=v消耗(NO2)=k逆c2(NO2),k正、k逆为速率常数只受温度影响。不同时刻测得容器中n(NO)、n(O2)如表:
2NO2(g) ΔH<0。实验测得:v正=v消耗(NO)=2v消耗(O2)=k正c2(NO)c(O2),v逆=v消耗(NO2)=k逆c2(NO2),k正、k逆为速率常数只受温度影响。不同时刻测得容器中n(NO)、n(O2)如表:
时间/ | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 1 | 0.6 | 0.4 | 0.2 | 0.2 | 0.2 |
n(O2)/mol | 0.6 | 0.4 | 0.3 | 0.2 | 0.2 | 0.2 |
①从0~2s该反应的平均速率v(NO2)=________mol/(Ls)。
②T1温度时,上述反应的化学平衡常数K=________。
③若将容器的温度改变为T2时其k正=k逆,则T1________T2(填“![]() ”“
”“![]() ”或“
”或“![]() ”)。
”)。
(4)电解硝酸工业的尾气NO可制备NH4NO3,其工作原理如图。
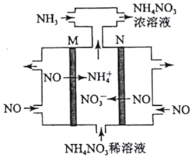
①N极的电极反应式为________________________。
②将电解生成的HNO3全部转化为NH4NO3,则通入的NH3与实际参加反应的NO的物质的量之比至少为________。
【题目】已知,常温下H2S、H2CO3 的电离常数如下表
Ka1 | Ka2 | |
H2S | 9.1×10-8 | 1×10-15 |
H2CO3 | 4.3×10-7 | 5.6×10-11 |
(1)①常温下,0.1mol/L的硫化钠溶液和0.1mol.L-1的碳酸钠溶液,碱性更强的是_______。其原因是_____________________________。
② 常温下,硫化钠水解的离子方程式_____________________________。
(2)H2S能与许多金属离子发生反应,生成溶解度不同和各种颜色的金属硫化物沉淀,可用于分离和鉴定金属离子。
①常温下,NaHS溶液显______(选填“酸性”、“中性”或“碱性”)
②常温下,向100 mL 0.1 mol·L-1 H2S溶液中滴加0.1 mol·L-1NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示:

试分析图中a、b、c、d四个点,水的电离程度最大的是________;在b点,溶液中各离子浓度由大到小的排列顺序是______________________________。
(3)脱除天然气中的硫化氢既能减少环境污染,又可回收硫资源,该部分硫化氢用过量NaOH溶液吸收后,再以石墨作电极电解该溶液可回收硫,写出电解得到硫的总反应方程式(忽略氧的氧化还原)_______________;从整个生产工艺的角度分析,该方法不仅能减少环境污染、回收硫、得到一定量的副产物,还具有的优点是___________。