题目内容
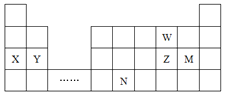
【题目】W、X、Y、Z、M、N六种主族元素,它们在周期表中位置如图所示,下列说法正确的是( )
A.原子半径:![]() 简单离子半径:
简单离子半径:![]()
B.单质的还原性:![]() 简单氢化物的沸点:
简单氢化物的沸点:![]()
C.溴与元素M同主族,最高价氧化物的水化物的酸性比M的强
D.元素N位于金属与非金属的分界线附近,可以推断N的单质可作半导体材料
【答案】D
【解析】
W、X、Y、Z、N六种主族元素,根据它们在周期表中位置可知,W为O元素、X为Na、Y为Mg、Z为S、M为Cl、N为Ge元素。
A.电子层越多原子半径越大,同周期从左向右原子半径减小,则原子半径为![]() ,电子层相同时,核电荷数越大,原子半径越小,应为
,电子层相同时,核电荷数越大,原子半径越小,应为![]() ,故A错误;
,故A错误;
B.金属性越强,对应金属的还原性越强,则还原性![]() ,O对应的氢化物分子间可形成氢键,沸点较高,应为
,O对应的氢化物分子间可形成氢键,沸点较高,应为![]() ,故B错误;
,故B错误;
C.溴与元素![]() 同主族,非金属性
同主族,非金属性![]() ,则最高价氧化物的水化物的酸性比M的弱,故C错误;
,则最高价氧化物的水化物的酸性比M的弱,故C错误;
D.由于元素N位于金属与非金属的分界线附近,则N元素的单质可作半导体材料,故D正确。
答案选D。

 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案 互动课堂系列答案
互动课堂系列答案【题目】下列实验操作不能达到相应实验目的的是
选项 | 实验操作 | 实验目的 |
A | 向苯与液溴的混合液中加入铁粉,将产生的气体直接通入AgNO3溶液中 | 验证液溴与苯发生取代反应 |
B | 向5mL浓度为0.5mol·L-1的KI溶液中滴加少量氯化铁溶液,再加入少量淀粉溶液,振荡 | 比较I-、Fe2+的还原性强弱 |
C | 向5mL浓度为0.2mol·L-1的MgCl2溶液中滴加少量NaOH溶液,待有白色沉淀生成后,再滴加0.2mol·L-1的CuCl2溶液 | 比较Cu(OH)2、Mg(OH)2溶度积的大小 |
D | 向 | 验证与H+的结合能力: |
A.AB.BC.CD.D
【题目】表为元素周期表短周期的一部分,下列有关A、B、C、D四种元素的叙述正确的是( )
A | B | C | ||
D | ||||
A.原子半径大小比较为D>C>B>A
B.生成的氢化物分子间均可形成氢键
C.A与C形成的阴离子可能有AC![]() 、A2C
、A2C![]()
D.A、B、C、D的单质常温下均不导电
【题目】下列粒子![]() 分子或离子
分子或离子![]() 均含有18个电子:
均含有18个电子:
粒子 | A+ | B2- | C | D | E | F |
组成特点 | 单核离 | 化合物, 双核分子 | 单质, 双核分子 | 化合物, 三核分子 | 化合物, 四核分子 | |
下列说法错误的是
A.A的元素符号是K,B2-的离子结构示意图是![]()
B.C的浓溶液可用于实验室制Cl2
C.D的单质具有强氧化性,可将其同族元素的单质从盐溶液中置换出来
D.F中可能既含极性键又含非极性键