题目内容
15.(1)某甲醇燃料电池原理如图1所示.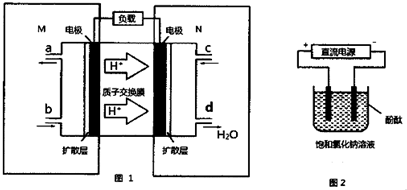
①M区发生反应的电极反应式为CH3OH-6e-+H2O=CO2+6H+.
②用上述电池做电源,用图2装置电解饱和食盐水(电极均为惰性电极),假设溶液体积为300mL,当溶液的pH值变为13时(在常温下测定),理论上消耗甲醇的质量为0.16g(忽略溶液体积变化).
(2)有一种用CO2生产甲醇燃料的方法:
已知:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-a kJ•mol-1;
CH3OH(g)=CH3OH(l)△H=-b kJ•mol-1;
2H2(g)+O2(g)=2H2O(g)△H=-c kJ•mol-1;
H2O(g)=H2O(l)△H=-d kJ•mol-1,
则表示CH3OH(l)燃烧热的热化学方程式为:CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-($\frac{3}{2}$c+2d-a-b)kJ•mol-1.
分析 (1)①首先根据氢离子的移动方向来确定正负极,然后根据原电池原理,最后书写电极反应式;
②整个电路中转移电子的数目相等,可以根据电子转移的数目相同来列出已知物质和未知物质之间关系式,然后通过关系来求解;
(2)应用盖斯定律解题,始终抓住目标反应和已知反应之间的关系应用数学知识来解.
解答 解:(1)①M区是质子流出的一极,应是原电池的负极,发生氧化反应,电极反应式为:CH3OH-6e-+H2O=CO2+6H+,故答案为:CH3OH-6e-+H2O=CO2+6H+;
②用惰性电极,电解饱和食盐水总的电极反应式为2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$ H2↑+Cl2↑+2 OH-,pH值变为13时,pOH=1,C(OH-)=10-1mol/L,n(OH-)=10-1mol/L×300mL×10-3L/mL=0.03mol,由方程式CH3OH-6e-+H2O=CO2+6H+,2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$ H2↑+Cl2↑+2 OH-
可知 CH3OH~6e-~6OH-
32g 6mol
m(CH3OH) 0.03mol
则m(CH3OH)=32g×0.03mol÷6mol=0.16g,
故答案为:0.16g;
(2)应用盖斯定律解题,△H=-△H1-△H2+$\frac{3}{2}$△H3+2△H4=-($\frac{3}{2}$c+2d-a-b)kJ•mol-1,所以CH3OH(l)燃烧热的热化学方程式为CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-($\frac{3}{2}$c+2d-a-b)kJ•mol-1,故答案为:CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-($\frac{3}{2}$c+2d-a-b)kJ•mol-1.
点评 本题考查了电极反应式的书写,以及盖斯定律的应用,综合性强,但难度不大.

 53随堂测系列答案
53随堂测系列答案| A. | 氧化铜(铜) | B. | 碳酸钙(氯化银) | C. | 氢氧化铁(氯化铁) | D. | 氢氧化钠(氯化钠) |
| A. | 分子中键的极性越强,分子越稳定 | |
| B. | 分子中共价键的键能越大,该物质的性质越不活泼 | |
| C. | 分子中共价键的键能越大,键越长,则分子越稳定 | |
| D. | 若把H2S写成H3S,违背了共价键的饱和性 |
| 族 周期 | I A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 1 | A | |||||||
| 2 | D | E | G | H | J | |||
| 3 | B | C | F | I |
(2)最高价氧化物的水化物碱性最强的是NaOH,酸性最强的是HClO4,呈两性的是Al(OH)3.
(3)A分别与D、E、F、H、I形成的化合物中,最稳定的HF,
(4)在B、C、E、F、H、I中,原子半径最大的是Na,
(5)D和G组成化合物的电子式
 ,
,(6)A和E组成化合物可否用浓硫酸干燥不能;原因是:2NH3+H2SO4=(NH4)2SO4(用化学方程式回答)
(7)B与G形成1:1型化合物中含有的化学键类型离子键、共价键,
(8)B的最高价氧化物的水化物和C的最高价氧化物相互反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O.
 某温度下,体积和pH都相同的稀硫酸和硫酸铝溶液加水稀释时的pH变化曲线如图,下列有关说法正确的是( )
某温度下,体积和pH都相同的稀硫酸和硫酸铝溶液加水稀释时的pH变化曲线如图,下列有关说法正确的是( )| A. | 加等量的水后硫酸中水电离出的C(H+)与硫酸铝中水电离出的C(H+)的比值比稀释前的比值增大 | |
| B. | a点溶液中有:c(H+)+c(Al3+)=c(OH-)+c(SO42-) | |
| C. | 体积和pH都相同的稀硫酸和硫酸铝溶液与等浓度的NaOH反应,消耗NaOH的体积相等 | |
| D. | b、c两溶液水电离出的c(OH-)相等 |
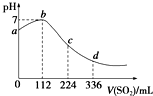
| A. | b点对应的溶液导电性最强 | |
| B. | 亚硫酸是比氢硫酸更弱的酸 | |
| C. | ab段反应是SO2+2H2S═3S↓+2H2O | |
| D. | 原H2S溶液的物质的量浓度为0.05mol•L-1 |
| A. | 大部分蔬菜和水果属于碱性食物 | B. | 大米和面粉属于酸性食物 | ||
| C. | 牛奶遇碘水变蓝色 | D. | 鸡蛋和牛奶含有较多蛋白质 |


