��Ŀ����
��֪����������Ԫ��X��Y��Z��W��ԭ����������������X��Y��ԭ������֮�͵���Z��ԭ��������X��Z���γ�X2Z��X2Z2���ֻ����W�Ƕ���������Ԫ���а뾶����Ԫ�ء�
��1��W�����ڱ��е�λ�ã� ��
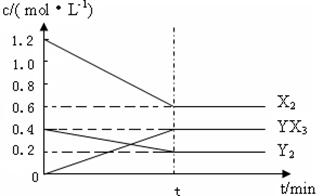
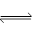
��2����һ�������£��ݻ�Ϊ1L�ܱ������м���1.2molX2��0.4molY2 ���������·�Ӧ��
3X2 (g) + Y2(g) ![]() 2YX3(g) ��H
2YX3(g) ��H
��Ӧ�����ʵ���Ũ����ʱ��仯���£�
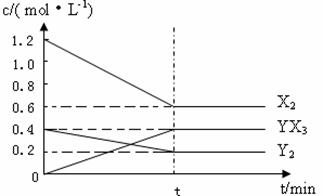
�ټ�����¶��´˷�Ӧ��ƽ�ⳣ��K= ��
���������¶�ƽ�ⳣ��K��С������H 0���>������<����=������
�۸ı�������������ʹ��ƽ��������Ӧ�����ƶ���ƽ�ⳣ��������� ������ĸ����
a.����ѹǿ b. �����¶� c.ʹ�ô��� d. ����Ӧ���Ũ��
��3������Һ̬������X2Z2��ϡ��Һ�ױ����ֽ⣬��ʹ�õĴ���Ϊ ������ĸ����
a��MnO2 b��FeCl3 c��Na2SO3 d��KMnO4
��4��A������Ԫ��������Ԫ����ɵĵ���ʣ���Һ�ʼ��ԣ���������0.1mol��L��1��A��Һϡ����ԭ�����10������Һ��pH=12����A�ĵ���ʽΪ ��
��5����X2Ϊȼ�Ͽ��Ƴ�ȼ�ϵ�ء���֪��2X2(g)+Z2(g)=2X2Z(l) ��H=−572KJ��mol��1
��ȼ�ϵ���ͷ�228��8KJ����ʱ������1molҺ̬X2Z���õ�ص�����ת����Ϊ ��
��(1)��������,IA(2��) (2)��K= 100/27��3.7 L2 / mol2 ��2�֣� �ڣ�(1��) ��ad��2�֣� ��ab��2�֣� ��![]() ��2�֣� ��80%����2�֣���
��2�֣� ��80%����2�֣���

 ��������ܸ�ϰϵ�д�
��������ܸ�ϰϵ�д���������
| A������Ԫ�ؾ����γɲ�ͬ��ͬ�������� | B��X��Y��W�ֱ�����γ�XY2��XW2������ | C���⻯���ȶ�����ǿ�������ǣ�Q��W��Z��X | D��W�γɼ������Ӱ뾶С��Q�γɼ������Ӱ뾶 |
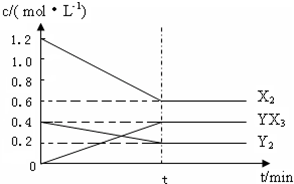
 2YX3(g) ��H
2YX3(g) ��H 
 2YX3(g) ��H
2YX3(g) ��H