题目内容
(11分)已知短周期主族元素X、Y、Z、W,原子序数依次增大且X和Y的原子序数之和等于Z的原子序数,X和Z可形成X2Z,X2Z2两种化合物,W是短周期主族元素中半径最大的元素。
⑴W在周期表中的位置: 。
⑵在一定条件下,容积为1L密闭容器中加入1.2molX2和0.4molY2,发生如下反应:
3X2 (g) + Y2(g) 2YX3(g) △H 反应各物质的量浓度随时间变化如下:
①此反应的平衡常数表达式为 (用化学式表示) , K= 。
②若升高温度平衡常数K减小,则△H 0(填>,<)。
⑶A1是四种元素中三种元素组成的电解质,溶液呈碱性,将0.1mol·L-1的A1溶液稀释至原体积的10倍后溶液的pH=12,则A1的电子式为 。
⑷B1、B2是由四种元素三种形成的强电解质,且溶液呈酸性,相同浓度时B1溶液中水的电离程度小于B2溶液中水的电离程度,其原因是 。
⑸A2和B1反应生成B2,则0.2mol/LA2和0.1mol/LB1等体积混合后溶液中离子浓度大小关系为 。
(1)第三周期,IA(2分)
(2)①K= C(NH3)2/[C(H2)3C(N2)] (1分)100/27 (mol/L)-2 (2分) ②<(1分)
(3)NaOH电子式(1分)
(4)硝酸电离的氢离子抑制了水的电离,铵根离子的存在促进了水的电离
(2分)
(5)C(NH4+)> C(NO3-)>C(OH-)>C(H+)(2分)
解析:根据元素原子结构特点可推出各元素为X为氢,Y为氮,Z为氧,W为
钠。从而通过分析思考进行解答。

 名校通行证有效作业系列答案
名校通行证有效作业系列答案
 2YX3(g) △H 反应各物质的量浓度随时间变化如下:
2YX3(g) △H 反应各物质的量浓度随时间变化如下: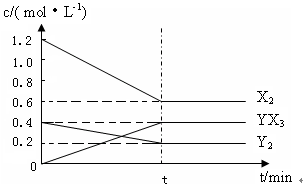

 2YX3(g) △H 反应各物质的量浓度随时间变化如下:
2YX3(g) △H 反应各物质的量浓度随时间变化如下: