题目内容
已知短周期主族元素X、Y、Z、W,原子序数依次增大且X和Y的原子序数之和等于Z的原子序数,X和Z可形成X2Z,X2Z2两种化合物,W是短周期主族元素中半径最大的元素.
(1)W在周期表中的位置: .
(2)在一定条件下,容积为1L密闭容器中加入1.2molX2和0.4molY2,发生如下反应:
3X2(g)+Y2(g)?2YX3(g)△H
反应各物质的量浓度随时间变化如图:
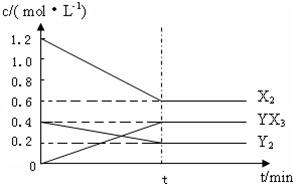
①此反应的平衡常数表达式为 (用化学式表示),K= .
②若升高温度平衡常数K减小,则△H 0(填“>”,“<”).
(3)A1是四种元素中三种元素组成的电解质,溶液呈碱性,将0.1mol?L-1的A1溶液稀释至原体积的10倍后溶液的pH=12,则A1的电子式为 .
(4)B1、B2是由四种元素三种形成的强电解质,且溶液呈酸性,相同浓度时B1溶液中水的电离程度小于B2溶液中水的电离程度,其原因是 .
(5)A2和B1反应生成B2,则0.2mol/LA2和0.1mol/L B1等体积混合后溶液中离子浓度大小关系为 .
(1)W在周期表中的位置:
(2)在一定条件下,容积为1L密闭容器中加入1.2molX2和0.4molY2,发生如下反应:
3X2(g)+Y2(g)?2YX3(g)△H
反应各物质的量浓度随时间变化如图:

①此反应的平衡常数表达式为
②若升高温度平衡常数K减小,则△H
(3)A1是四种元素中三种元素组成的电解质,溶液呈碱性,将0.1mol?L-1的A1溶液稀释至原体积的10倍后溶液的pH=12,则A1的电子式为
(4)B1、B2是由四种元素三种形成的强电解质,且溶液呈酸性,相同浓度时B1溶液中水的电离程度小于B2溶液中水的电离程度,其原因是
(5)A2和B1反应生成B2,则0.2mol/LA2和0.1mol/L B1等体积混合后溶液中离子浓度大小关系为
分析:短周期主族元素X、Y、Z、W,原子序数依次增大,X和Z可形成X2Z,X2Z2两种化合物,且X的原子序数小于Z,则X为H元素,Z为O元素,X和Y的原子序数之和等于Z的原子序数,则Y为N元素,W是短周期主族元素中半径最大的元素,则W为Na元素;
(1)主族元素中,原子的电子层数等于其周期数,最外层电子数等于其族序数;
(2)①化学平衡常数K=
,根据平衡时各物质的浓度进行计算;
②升高温度,平衡向吸热反应方向移动;
(3)A1是四种元素中三种元素组成的电解质,溶液呈碱性,将0.1mol?L-1的A1溶液稀释至原体积的10倍后溶液的pH=12,说明该物质是强碱,则为NaOH;
(4)酸抑制水电离,含有弱根离子的盐促进水电离;
(5)根据溶液中的溶质及溶液的酸碱性判断离子浓度大小顺序.
(1)主族元素中,原子的电子层数等于其周期数,最外层电子数等于其族序数;
(2)①化学平衡常数K=
| c2(NH3) |
| c(N2)?c3(H2) |
②升高温度,平衡向吸热反应方向移动;
(3)A1是四种元素中三种元素组成的电解质,溶液呈碱性,将0.1mol?L-1的A1溶液稀释至原体积的10倍后溶液的pH=12,说明该物质是强碱,则为NaOH;
(4)酸抑制水电离,含有弱根离子的盐促进水电离;
(5)根据溶液中的溶质及溶液的酸碱性判断离子浓度大小顺序.
解答:解:短周期主族元素X、Y、Z、W,原子序数依次增大,X和Z可形成X2Z,X2Z2两种化合物,且X的原子序数小于Z,则X为H元素,Z为O元素,X和Y的原子序数之和等于Z的原子序数,则Y为N元素,W是短周期主族元素中半径最大的元素,则W为Na元素;
(1)主族元素中,原子的电子层数等于其周期数,最外层电子数等于其族序数,W原子核外有3个电子层,最外层有1个电子,所以W元素位于第三周期第ⅠA族,
故答案为:第三周期第ⅠA族;
(2)①化学平衡常数K=
,平衡时,c(H2)=0.6mol/L,c(N2)=0.2mol/L,c(NH3)=0.4mol/L,
所以K=
(mol/L)-2=
(mol/L)-2,
故答案为:K=
;
(mol/L)-2;
②升高温度,K减小,说明平衡向逆反应方向移动,则正反应为放热反应,△H<0,
故答案为:<;
(3)A1是四种元素中三种元素组成的电解质,溶液呈碱性,将0.1mol?L-1的A1溶液稀释至原体积的10倍后溶液的pH=12,说明该物质是强碱,则为NaOH,其电子式为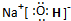 ,
,
故答案为: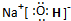 ;
;
(4)酸抑制水电离,含有弱根离子的盐促进水电离,B1、B2是由四种元素三种形成的强电解质,且溶液呈酸性,相同浓度时B1溶液中水的电离程度小于B2溶液中水的电离程度,所以B1为硝酸,B2为硝酸铵,硝酸电离的氢离子抑制了水的电离,铵根离子的存在促进了水的电离,
故答案为:硝酸电离的氢离子抑制了水的电离,铵根离子的存在促进了水的电离;
(5)A2和硝酸反应生成硝酸铵,则A2为一水合氨,则0.2mol/LA2和0.1mol/L B1等体积混合后,溶液中的物质为等物质的量浓度的一水合氨和硝酸铵,一水合氨的电离程度大于铵根离子的水解程度,溶液溶液呈碱性,则c(OH-)>c(H+),根据电荷守恒得c(NH4+)>c(NO3-),溶液中盐电离为主,所以c(NO3-)>c(OH-),所以溶液中离子浓度大小关系为c(NH4+)>c(NO3-)>c(OH-)>c(H+),
故答案为:c(NH4+)>c(NO3-)>c(OH-)>c(H+).
(1)主族元素中,原子的电子层数等于其周期数,最外层电子数等于其族序数,W原子核外有3个电子层,最外层有1个电子,所以W元素位于第三周期第ⅠA族,
故答案为:第三周期第ⅠA族;
(2)①化学平衡常数K=
| c2(NH3) |
| c(N2)?c3(H2) |
所以K=
| 0.4×0.4 |
| 0.2×(0.6)3 |
| 100 |
| 27 |
故答案为:K=
| c2(NH3) |
| c(N2)?c3(H2) |
| 100 |
| 27 |
②升高温度,K减小,说明平衡向逆反应方向移动,则正反应为放热反应,△H<0,
故答案为:<;
(3)A1是四种元素中三种元素组成的电解质,溶液呈碱性,将0.1mol?L-1的A1溶液稀释至原体积的10倍后溶液的pH=12,说明该物质是强碱,则为NaOH,其电子式为
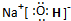 ,
,故答案为:
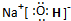 ;
;(4)酸抑制水电离,含有弱根离子的盐促进水电离,B1、B2是由四种元素三种形成的强电解质,且溶液呈酸性,相同浓度时B1溶液中水的电离程度小于B2溶液中水的电离程度,所以B1为硝酸,B2为硝酸铵,硝酸电离的氢离子抑制了水的电离,铵根离子的存在促进了水的电离,
故答案为:硝酸电离的氢离子抑制了水的电离,铵根离子的存在促进了水的电离;
(5)A2和硝酸反应生成硝酸铵,则A2为一水合氨,则0.2mol/LA2和0.1mol/L B1等体积混合后,溶液中的物质为等物质的量浓度的一水合氨和硝酸铵,一水合氨的电离程度大于铵根离子的水解程度,溶液溶液呈碱性,则c(OH-)>c(H+),根据电荷守恒得c(NH4+)>c(NO3-),溶液中盐电离为主,所以c(NO3-)>c(OH-),所以溶液中离子浓度大小关系为c(NH4+)>c(NO3-)>c(OH-)>c(H+),
故答案为:c(NH4+)>c(NO3-)>c(OH-)>c(H+).
点评:本题考查以物质结构元素推断为载体涉及化学平衡、电解质溶液、盐类的水解及离子浓度大小的考查,根据平衡常数计算公式、外界条件对化学平衡的影响、电荷守恒等知识点来分析解答,难度中等.

练习册系列答案
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案
相关题目
已知短周期主族元素X、Y、Z、W、Q的原子序数逐渐增大,其中X和Z、Y和W分别为同主族元素,X元素的原子内层电子数是最外层电子数的一半,W的最高价氧化物对应的水化物是二元强酸,则下列说法中正确的是
( )
( )
| A、五种元素均能形成不同种同素异形体 | B、X和Y、W分别可以形成XY2、XW2化合物 | C、氢化物稳定性由强到弱的是:Q、W、Z、X | D、W形成简单阴离子半径小于Q形成简单阴离子半径 |
 2YX3(g) △H
2YX3(g) △H 
 2YX3(g) △H
2YX3(g) △H 