题目内容
8. 在一容积为2L的密闭容器内为加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0反应中NH3的物质的量浓度的变化的情况如图所示:
在一容积为2L的密闭容器内为加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0反应中NH3的物质的量浓度的变化的情况如图所示:(1)根据图象,计算从反应开始到平衡时(4min达到平衡),平均反应速率υ(NH3)=0.0125 mol•L-1•min-1.
(2)该反应平衡常数表达式K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2}){c}^{3}({H}_{2})}$.
(3)反应达到平衡后,第5分钟末,保持其他条件不变,若改变反应温度,则NH3的物质的量浓度不可能为AC(填字母序号).
A.0.20mol•L-1 B.0.12mol•L-1
C.0.10mol•L-1 D.0.08mol•L-1
(4)反应达到平衡后,第5分钟末,保持其他条件不变,若只把容器的体积缩小一半,平衡向正反应方向移动(填“向逆反应方向”、“向正反应方向”或“不”),化学平衡常数不变(填“增大”、“减小”或“不变”).
(5)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25mol•L-1).请在图中画出第5分钟末到此平衡时NH3浓度的变化曲线.
分析 (1)根据v(NH3)=$\frac{△c}{△t}$进行计算;
(2)平衡常数等于生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积;
(3)改变反应温度,平衡一定移动,而氮气和氢气不可能完全转化为氨气,所以v(NH3)<0.20mol/L,由此分析解答;
(4)保持其它条件不变,若只把容器的体积缩小一半,相当增大压强,平衡正向移动;化学平衡常数是温度的函数,温度不变K不变;
(5)先判断把容器的体积缩小一半的瞬间氨气的浓度,再结合平衡时的浓度作图;
解答 解:(1)根据图象分析平衡时氨气的浓度为0.1mol/L,时间为4min,所以依据速率之比等于系数之比得到:v(NH3)=$\frac{0.1mol/L}{4min}$=0.0125 mol/(L•min),故答案为:0.0125 mol/(L•min);
(2)N2(g)+3H2(g)?2NH3(g),反应的平衡常数K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2}){c}^{3}({H}_{2})}$,
故答案为:$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2}){c}^{3}({H}_{2})}$;
(3)改变反应温度,平衡一定移动,而氮气和氢气不可能完全转化为氨气,所以v(NH3)<0.20mol/L,
A. 如果氨气的浓度是0.20mol/L,则氮气与氢气完全转化,故错误;
B.降低温度,氨气的浓度可能为0.12mol/L,故正确;
C.温度改变,平衡一定移动,所以不可能为0.10mol/L,故错误;
D.升高温度,平衡逆向移动,所以氨气浓度变小,可能为:0.08mol/L,故正确;
故选:AC;
(4)该反应是气体体积减小的反应,把容器的体积缩小一半,增大了反应体系的压强,增大压强,平衡向气体体积减小的方向移动,即向正反应方向移动;化学平衡常数只与温度有关,温度不变,平衡常数不变,
故答案为:向正反应方向;不变;
(5)把容器的体积缩小一半的瞬间氨气的浓度,氨气的浓度变为0.20mol/L,平衡后浓度约为0.25mol/L,所以第5分钟末到此平衡时NH3浓度的变化曲线为: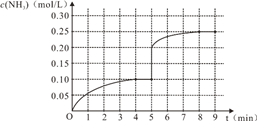 ,
,
故答案为: .
.
点评 本题考查了化学反应速率、化学平衡移动的影响因素、化学平衡常数的影响因素等,解题的关键点在于识图能力,同时对学生作图能力也有一定的要求,中等难度.

| A. | 吸热反应 | B. | 放热反应 | ||
| C. | 反应的△H=0 | D. | 无法判断是吸热反应还是放热反应 |
| A. | 常温常压下,8 g O2含有4NA个电子 | |
| B. | 盛有SO2的密闭容器中含有NA个氧原子,则SO2的物质的量为0.5 mol | |
| C. | 常温常压下,14 g由N2与CO组成的混合气体含有的原子数目为NA | |
| D. | 常温常压下,22.4 L的NO2和CO2混合气体含有2NA个O原子 |
| A. | Va>Vb时:c (CH3COOH)+c (CH3COO-)>c (K+) | |
| B. | Va=Vb时:c(CH3COOH)+c (H+)=c(OH-) | |
| C. | Va<Vb时:c(CH3COO-)>c (K+)>c(OH-)>c(H+) | |
| D. | Va与Vb任意比时:c(K+)+c (H+)=c(OH-)+c(CH3COO-) |
| A. | 胶体带电荷,而溶液呈电中性 | |
| B. | 胶体加入电解质可产生沉淀,而溶液不能 | |
| C. | 胶体和溶液都是一种非常稳定的分散系 | |
| D. | 胶体能够发生丁达尔现象,而溶液则不能 |
| A. | 卢瑟福原子模型 | B. | 电子云模型 | C. | 汤姆生原子模型 | D. | 玻尔原子模型 |
| A. | 四氯化碳和水 | B. | 苯和水 | C. | 乙酸和水 | D. | 酒精和水 |