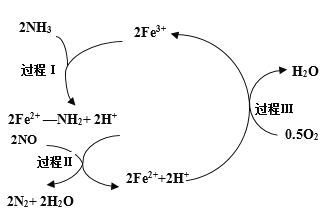
题目内容
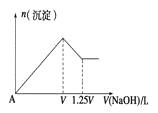
【题目】有MgCl2、Al2(SO4)3的混合溶液,向其中不断加入NaOH溶液,得到沉淀的物质的量与加入NaOH溶液体积的关系如图所示,则溶液中MgCl2与Al2(SO4)3的物质的量浓度之比为 ___________
【答案】1:1
【解析】
根据图像加入VLNaOH溶液时Mg2+、Al3+刚好完全沉淀,再加入(1.25V-V)L=0.25VLNaOH溶液将生成的Al(OH)3完全溶解,结合离子方程式计算。
设NaOH溶液物质的量浓度为cmol/L,根据图像,加入(1.25V-V)L=0.25VLNaOH溶液将生成的Al(OH)3完全溶解,依据反应Al(OH)3+OH-=AlO2-+2H2O可知,Al(OH)3物质的量为c×0.25Vmol=0.25cVmol;根据反应Al3++3OH-=Al(OH)3↓,Al3+物质的量为0.25cVmol,Al3+完全沉淀消耗的OH-物质的量为0.75cVmol;Mg2+完全沉淀消耗的OH-物质的量为cVmol-0.75cVmol=0.25cVmol,结合反应Mg2++2OH-=Mg(OH)2↓,Mg2+物质的量为0.125cVmol;溶液中Mg2+与Al3+物质的量之比为0.125cVmol:0.25cVmol=1:2,溶液中MgCl2与Al2(SO4)3物质的量之比为1:1,则溶液中MgCl2与Al2(SO4)3物质的量浓度之比为1:1。

练习册系列答案
相关题目