题目内容
【题目】如图所示为一定量AlCl3溶液中加入NaOH溶液后,产生Al(OH)3白色沉淀的质量与NaOH的物质的量之间的关系曲线。

请回答下列问题:
(1)A点时已参加反应的AlCl3和NaOH的物质的量之比为________。
(2)AB段曲线所表示的反应的离子方程式为_________________________。
(3)向B处生成的溶液中通入二氧化碳,可观察到的现象是_______________________。
(4)向含有0.1 mol NH4Al(SO4)2的溶液中逐滴加入5 mol·L-1 NaOH溶液,开始发现溶液中出现白色沉淀并逐渐增多;一段时间后有刺激性气味的气体逸出;最后白色沉淀逐渐减少并最终消失。请在下图中画出生成沉淀的物质的量与加入NaOH溶液体积的关系示意图。
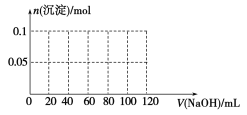
【答案】(1)13;(2)Al(OH)3+OH-===AlO2-+2H2O;(3)生成白色沉淀;
(4)
【解析】
试题分析:(1)A点沉淀达到最大,OA段发生离子反应方程式为:Al3++3OH-=Al(OH)3↓,两者物质的量之比为1:3;(2)氢氧化铝属于两性氢氧化物,因此AB段发生离子反应方程式为:Al(OH)3+OH-=AlO2-+2H2O;(3)B中溶质为NaAlO2,因为碳酸的酸性强于偏铝酸,因此有2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-,因此有白色沉淀产生;(4)Al3+得OH-的能力强于NH4+,因此先发生Al3++OH-=Al(OH)3↓,生成最大沉淀时,消耗NaOH的体积为60mL,然后发生NH4++OH-=NH3·H2O,此时沉淀的质量不变,此阶段消耗的NaOH的体积为20mL,最后发生的是Al(OH)3+OH-=AlO2-+2H2O,此时消耗的NaOH的体积为20mL,因此图像是: