题目内容
【题目】铜有很多重要的化合物。特别是Cu2+核外电子的特殊构型,其能与很多含有氧或氮元素的配体[如NH3、乙二胺(H2N—CH2—CH2—NH2)、乙酰丙酮(CH3COCH2COCH3)等]形成配合物。
(1)C、N、O元素的电负性由小到大的顺序是 。
(2)[Cu(NH3)4]2+呈深蓝色,该粒子中配位体的空间构型为 。
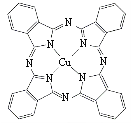
(3)酞菁铜也是Cu2+的一种配合物,被广泛用于墨水生产,其结构如图。请用箭头标出其中的配位键 ,该分子中氮原子的杂化方式为 。
(4)CuCl2在湿空气中潮解,易溶于水、乙醇和丙酮,熔点约100℃。推测氯化铜的晶体类型为 。
(5)Cu的晶胞如图所示,铜原子的配位数为 。

【答案】(1)C<N<O
(2)三角锥形
(3)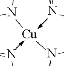 ;sp2 和sp3
;sp2 和sp3
(4)分子晶体
(5)12
【解析】
试题分析:(1)元素非金属性越强,得电子能力越强,其电负性的数值越大,所以C<N<O。
故答案为:C<N<O;
(2)该离子中中心离子是铜离子,配体是氨气分子,氨气分子中价层电子对个数=σ键个数+孤电子对个数=3+ ![]() (5-3×1)=4,且含有一个孤电子对,所以其空间构型为三角锥形。
(5-3×1)=4,且含有一个孤电子对,所以其空间构型为三角锥形。
故答案为:三角锥形;
(3)配位键由提供孤电子对的N原子指向提供空轨道的Cu2+,所以该配合物中的配位键为: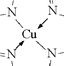 ;由图中可知N原子只与C原子相连时,N的杂化方式为sp2,与铜原子形成配位键时的杂化方式是sp3。
;由图中可知N原子只与C原子相连时,N的杂化方式为sp2,与铜原子形成配位键时的杂化方式是sp3。
故答案为: ;sp2 和sp3;
;sp2 和sp3;
(4)分子晶体的熔点低,一般易溶于水或有机溶剂,则氯化铜的晶体类型为分子晶体。
故答案为:分子晶体;
(5)晶胞中Cu原子位于面心、顶点上,属于面心立方最密堆积,以顶点Cu原子研究,与之相邻的原子处于面心,每个顶点为8个晶胞共用,每个面心为2个晶胞共有,故Cu原子配位数为![]() =12。
=12。
故答案为:12。

 名校课堂系列答案
名校课堂系列答案