题目内容
将一定量的镁和铜组成的混合物加入到稀硝酸中,金属完全溶解(假设反应中还原产物只有NO)。向反应后的溶液中加入3 mol/L NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1 g。下列叙述不正确的是
| A.当生成的沉淀量达到最大时,消耗NaOH溶液的体积V≥100 mL |
| B.当金属全部溶解时收集到NO气体的体积一定为2.24 L |
| C.参加反应的金属的总质量3.6 g<m<9.6 g |
| D.当金属全部溶解时,参加反应的硝酸的物质的量一定是0.4 mol |
B
解析试题分析:由题意可知,生成沉淀的质量比原合金的质量增加5.1g,即为增加的氢氧根离子的质量,所以氢氧根离子的物质的量为0.3mol,也是反应中转移电子的物质的量。A、沉淀中氢氧根离子的物质的量为0.3mol,则需要氢氧化钠的体积是100mL,所以当生成的沉淀量达到最大时,消耗NaOH溶液的体积V≥100 mL,正确;B、反应中转移电子的物质的量是0.3mol,即NO得物质的量是0.1mol,但未指明标准状况,所以气体的体积不一定是2.24L,错误;C、若金属全部是镁,则其质量为0.3mol/2×24g/mol=3.6g,若金属全部是铜,则其质量为0.3mol/2×64g/mol=9.6g,所以固体的质量介于3.6g~9.6g之间,正确;D、金属全部溶解时被还原的硝酸也即生成的NO的物质的量是0.1mol,未被还原的硝酸即与氢氧化钠反应生成硝酸钠的物质的量是0.3mol,所以共消耗硝酸0.4mol,正确,答案选B。
考点:考查氧化还原反应中得失电子守恒规律、元素守恒规律的应用

 备战中考寒假系列答案
备战中考寒假系列答案N2O俗称“笑气”,医疗上曾用作可吸入性麻醉剂,下列反应能产生N2O:3CO+2NO2=3CO2 +N2O。下列关于N2O的说法一定正确的是
| A.上述反应中,每消耗2mol NO2,就会生成22.4L N2O |
| B.N2O有氧化性,且为HNO2的酸酐 |
| C.等质量的N2O和CO2含有相等的电子数 |
| D.N2O会迅速与人体血红蛋白结合,使人中毒 |
已知KClO3与浓HCI反应的化学方程式为:KClO3+6HCl=KCl+3C12+3H2O,若用K35C1O3与H37Cl作用,则下列说法正确的是 ( )
| A.所得氯气的相对分子质量约为71 |
| B.KCl中只含35C1 |
| C.所得的KCl中既含35C1又含37Cl |
| D.被氧化和被还原的氯原子数之比为5∶1 |
某氮的氧化物和CO在催化剂的作用下充分反应,生成氮气和CO2 ,若测得氮气和CO2的物质的量之比为1:2,则该氮的氧化物是
| A.N2O | B.N2O5 | C.NO2 | D.NO |
将0.195g锌粉加入到20.0mL的0.100 mol·L-1MO2+溶液中,恰好完全反应,则还原产物可能是
| A.M | B.M2+ | C.M3+ | D.MO2+ |
下列说法正确的是
| A.强氧化剂与强还原剂不一定能发生氧化还原反应 |
| B.含最高价元素的化合物一定只表现强氧化性 |
| C.阳离子只有氧化性,阴离子只有还原性 |
| D.发生化学反应时,失电子越多的金属原子,还原能力越强 |
一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体V L(标准状况),向反应后的溶液中(存在Cu2+和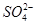 )加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO 12.0 g,若上述气体为NO和NO2的混合物,且体积比为1∶1,则V可能为
)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO 12.0 g,若上述气体为NO和NO2的混合物,且体积比为1∶1,则V可能为
| A.9.0 L | B.13.5 L | C.15.7 L | D.16.8 L |
O3具有强氧化性,将O3通入KI溶液中发生反应:O3+I-+H+―→I2+O2+H2O(未配平),下列说法正确的是 ( )。
| A.配平后的离子方程式为2O3+2I-+4H+=I2+2O2+2H2O |
| B.每生成1 mol I2转移电子2 mol |
| C.O2是还原产物之一 |
| D.该反应能说明O2的氧化性大于I2的 |
下列说法正确的是( )。
| A.高温下,可在试管内完成焦炭和石英砂(SiO2)制取硅的反应 |
| B.CO2和钠在一定条件下反应可以得到金刚石和碳酸钠,反应中氧化剂和还原剂的物质的量之比是3∶4 |
| C.现代海战通过喷放液体SiCl4(极易水解)和液氨可产生烟幕,其主要成分是NH4Cl |
| D.从燃煤烟道灰中(含GeO2)提取半导体材料单质锗(Ge),没有发生氧化还原反应 |