题目内容
12.取软锰矿(主要成分是MnO2)150g,与足量浓盐酸反应,把制得的氯气通入消石灰溶液中,可得次氯酸钙71.5g,那么软锰矿中二氧化锰的质量分数是多少?分析 依据方程式:MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,2Cl2+2Ca(OH)2═CaCl2+2H2O+Ca(ClO)2,可知MnO2~Cl2~0.5Ca(ClO)2,依据生成次氯酸钙71.5g,计算二氧化锰的质量,最后依据$\frac{m(二氧化锰)}{m(软锰矿)}$×100%计算软锰矿中二氧化锰的质量分数.
解答 解:依据方程式:MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,2Cl2+2Ca(OH)2═CaCl2+2H2O+Ca(ClO)2,浓盐酸足量,软锰矿中的二氧化锰完全反应,
则MnO2~Cl2~0.5Ca(ClO)2,
87g 0.5×143g
m 71.5g
87:m=(0.5×143g ):71.5g 解得m=87g,
软锰矿中二氧化锰的质量分数=$\frac{m(二氧化锰)}{m(软锰矿)}$×100%=$\frac{87g}{150g/mol}$×100%=58%;
答:软锰矿中二氧化锰的质量分数是58%.
点评 本题考查根据方程式进行的有关计算,明确发生的化学反应,依据方程式找出二氧化锰与次氯酸钙之间量的关系即可解答,题目难度不大.

练习册系列答案
相关题目
8.如果把Cu、Zn与稀H2SO4构成的原电池表示为Zn$\stackrel{H_{2}SO_{4}}{→}$Cu,则下列能表示原电池的是( )
| A. | Cu$\stackrel{H_{2}SO_{4}}{→}$Cu | B. | Cu$\stackrel{CuSO_{4}}{→}$Ag | C. | Zn$\stackrel{NH_{4}Cl}{→}$C | D. | Zn$\stackrel{C_{2}H_{5}OH}{→}$Cu |
17.下列说法不正确的是( )
| A. | Na2O2能与CO2反应,可用作呼吸面具的供氧剂 | |
| B. | 硅是半导体材料,可用于制备光导纤维 | |
| C. | 明矾能水解生成Al(OH)3胶体,可用作净水剂 | |
| D. | Al2O3熔点高,可用于制作耐高温仪器 |
4.下列有关说法正确的是( )
| A. | 蔗糖、淀粉、蛋白质、油脂都是营养物质,都属于高分子化合物,都能发生水解反应 | |
| B. | 人造纤维、合成纤维、碳纤维、光导纤维主要成分都是纤维素 | |
| C. | 乙醇、乙酸、乙酸乙酯都能发生取代反应,乙酸乙酯中的少量乙酸可用饱和Na2CO3溶液除去 | |
| D. | 甲烷、乙烯和苯在工业上都可通过石油分馏得到 |
1.相同质量的两份铝,分别放入足量的盐酸和氢氧化钠溶液中,放出的氢气在同温同压下的体积之比为( )
| A. | 3:2 | B. | 2:3 | C. | 1:3 | D. | 1:1 |
2.元素的性质呈周期性变化的根本原因是( )
| A. | 元素的原子半径呈周期性变化 | |
| B. | 元素原子量的递增,量变引起质变 | |
| C. | 元素的金属性和非金属性呈周期性变化 | |
| D. | 元素原子的核外电子排布呈周期性变化 |
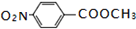
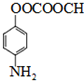
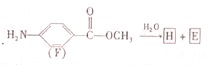
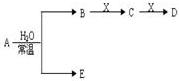 已知A、B、C、D、E、X存在如图所示转化关系(部分生成物和反应条件略去).
已知A、B、C、D、E、X存在如图所示转化关系(部分生成物和反应条件略去). .
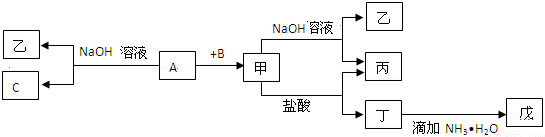
.
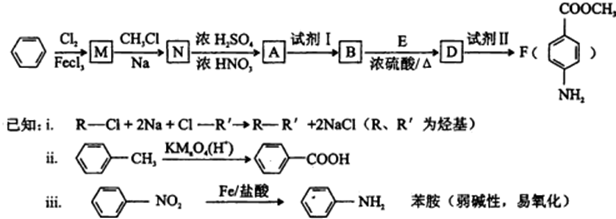
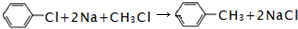 .
. .
. ;
; .
.
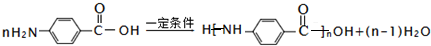 .
.