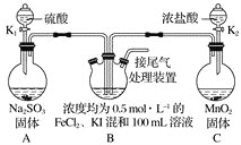
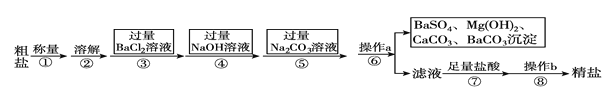
题目内容
【题目】NO2、O2和熔融NaNO3可制作燃料电池,其原理如图。该电池在使用过程中石墨1电极上生成氧化物Y。下列说去错误的是

A. 若将该电池中的熔融NaNO3换成NaOH溶液,则不可能产生电流
B. 该电池放电时NO3-从右侧向左侧迁移
C. 石墨I电极的电极反应式为NO2+NO3--e-=N2O5
D. 相同条件下,放电过程中消耗的NO2和O2的体积比为4︰1
【答案】A
【解析】
A.NO2、O2和NaOH溶液可以发生氧化还原反应,反应过程中有电子转移,故可产生电流,A项错误;
B.该反应中石墨I为负极,石墨Ⅱ为正极,阴离子从正极向负极迁移,即从右侧向左侧迁移,B项正确;
C.石墨I为负极,负极上发生氧化反应,故电极反应为NO2+NO3--e-=N2O5,故C正确;
D.放电过程中总反应为4NO2+O2==2N2O5,消耗的NO2和O2的体积比为4︰1,故D正确。
本题选A。

【题目】化学课上,同学们利用下列实验探究碱的化学性质:

(1)A实验中观察到的现象是_______。
(2)B实验中发生的离子反应方程式是_____。
(3)C实验中发生的离子反应方程式是____。
(4)实验结束后,同学们将废液倒入同一只废液缸中,最后发现废液浑浊并显红色。
(提出问题)废液中含有什么物质?
(假设猜想)通过分析,同学们猜想:废液中除酚酞、碳酸钙及水以外一定含有_____。
老师问:废液中还可能有什么物质?引发了同学们热烈讨论,下面是大家的发言:
学生甲 | 可能有CaCl2、Na2CO3 | 学生丙 | 可能有Ca(OH)2、CaCl2 |
学生乙 | 可能有NaOH、Na2CO3 | 学生丁 | 可能有Na2CO3 |
学生戊 | 可能有NaOH | … | … |
上述几位学生的猜想中,有一种明显不合理,你认为谁的猜想不合理?并说明理由。_____
(实验验证)同学们对可能含有的物质进行确定,取一定量的废液过滤,向滤液中逐滴加入氯化钡溶液,得到白色沉淀,红色褪去。
(结论)上述废液中,还含有____,没有_____。