题目内容
【题目】浓差电池有多种:一种是利用物质氧化性或还原性强弱与浓度的关系设计的原电池(如图1):一种是根据电池中存在浓度差会产生电动势而设计的原电池(如图2)。图1所示原电池能在一段时间内形成稳定电流;图2所示原电池既能从浓缩海水中提取LiCl,又能获得电能。下列说法错误的是

A.图1电流计指针不再偏转时,左右两侧溶液浓度恰好相等
B.图1电流计指针不再偏转时向左侧加入NaCl或AgNO3或Fe粉,指针又会偏转且方向相同
C.图2中Y极每生成1 mol Cl2,a极区得到2 mol LiCl
D.两个原电池外电路中电子流动方向均为从右到左
【答案】B
【解析】
图1左边硝酸银浓度大于右边硝酸银浓度,设计为原电池时,右边银失去电子,化合价升高,作原电池负极,左边是原电池正极,得到银单质,硝酸根从左向右不断移动,当两边浓度相等,则指针不偏转;图2氢离子得到电子变为氢气,化合价降低,作原电池正极,右边氯离子失去电子变为氯气,作原电池负极。
A. 根据前面分析得到图1中电流计指针不再偏转时,左右两侧溶液浓度恰好相等,故A正确;
B. 开始时图1左边为正极,右边为负极,图1电流计指针不再偏转时向左侧加入NaCl或Fe,左侧银离子浓度减小,则左边为负极,右边为正极,加入AgNO3,左侧银离子浓度增加,则左边为正极,右边为负极,因此指针又会偏转但方向不同,故B错误;
C. 图2中Y极每生成1 mol Cl2,转移2mol电子,因此2mol Li+移向a极得到2 mol LiCl,故C正确;
D. 两个电极左边都为正极,右边都为负极,因此两个原电池外电路中电子流动方向均为从右到左,故D正确。
综上所述,答案为B。

 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案【题目】某课外活动小组用如图所示的实验装置探究氯气与氨气之间的反应。其中A、F为氨气和氯气的发生装置,C为纯净、干燥的氯气与氨气反应的装置。
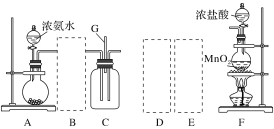
备选装置 | ||
|
|
|
Ⅰ | Ⅱ | Ⅲ |
请回答下列问题:
(1)装置F中发生反应的离子方程式是___________________________________。
(2)装置A中的烧瓶内固体可选用________(填字母)。
A.碱石灰 B.浓硫酸 C.生石灰 D.五氧化二磷 E.烧碱
(3)虚线框内应添加必要的除杂装置,请从如图的备选装置中选择,并将编号填入下列空格:
B:________、D:________、E:________。
(4)氯气和氨气在常温下混合就能发生反应生成氯化铵和氮气,该反应的化学方程式为:____________________________________;
(5)装置C内出现浓厚的白烟并在容器内壁凝结,请设计一个实验方案确定该白色固体中的阳离子:_______________________________________
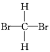
【题目】实验室制备1,2-二溴乙烷的反应原理如下所示:
第一步:CH3CH2OH![]() CH2=CH2+H2O;
CH2=CH2+H2O;
第二步:乙烯与溴水反应得到1,2-二溴乙烷。
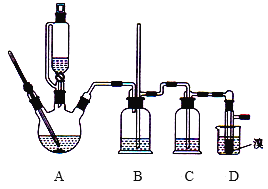
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃下脱水生成乙醚(CH3CH2OCH2CH3)。用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示(部分装置未画出):
有关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/(g/cm3) | 0.79 | 2.2 | 0.71 |
沸点/(℃) | 78.5 | 132 | 34.6 |
熔点/(℃) | -130 | 9 | -116 |
请回答下列问题:
(1)写出乙烯与溴水反应的化学方程式:______。
(2)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是_____(填字母代号)。
a.引发反应 b.加快反应速率
c.防止乙醇挥发 d.减少副产物乙醚生成
(3)装置B的作用是______。
(4)在装置C中应加入____ (填字母代号),其目的是吸收反应中可能生成的SO2、CO2气体。
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(5)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在___ (填“上”或“下”)层。
(6)若产物中有少量副产物乙醚,可用____的方法除去。
【题目】一定温度下,在三个体积均为0.5 L的恒容密闭容器中发生反应:CO(g)+Cl2(g)![]() COCl2(g),其中容器Ⅰ中反应在5 min时达到平衡状态。
COCl2(g),其中容器Ⅰ中反应在5 min时达到平衡状态。
容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | ||
CO | Cl2 | COCl2 | COCl2 | ||
Ⅰ | 500 | 1.0 | 1.0 | 0 | 0.8 |
Ⅱ | 500 | 1.0 | a | 0 | 0.5 |
Ⅲ | 600 | 0.5 | 0.5 | 0.5 | 0.7 |
下列说法中正确的是
A. 容器Ⅰ中前5 min的平均反应速率v(CO)=0.16 mol·L-1·min-1
B. 该反应正反应为吸热反应
C. 容器Ⅱ中起始时Cl2的物质的量为0.55 mol
D. 若起始时向容器Ⅰ加入CO0.8mol、Cl20.8mol,达到平衡时CO转化率大于80%
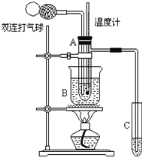
【题目】乙醛在催化剂存在的条件下,可以被空气氧化成乙酸。依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体),已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全。有关物质的沸点见下:
物质 | 乙醛 | 乙酸 | 甘油 | 乙二醇 | 水 |
沸点 | 20.8℃ | 117.9℃ | 290℃ | 197.2℃ | 100℃ |
请回答下列问题:
(1)试管A内在60℃~80℃时发生的主要反应的化学方程式为(注明反应条件)_____________________________________________;
(2)如图所示在实验的不同阶段,需要调整温度计在试管A内的位置:
①在实验开始时温度计水银球的位置应在_____________________;
②当试管A内的主要反应完成后温度计水银球的位置应在_______________,目的是________________________________________________;
(3)烧杯B内盛装的液体可以是________(写出一种即可);在实验的不同阶段,烧杯B的作用分别是_________________、______________________;
(4)若想检验试管C中是否含有产物乙酸,请你在所提供的药品中进行选择,设计一个简便的实验方案。所提供的药品有:pH试纸、红色的石蕊试纸、白色的醋酸铅试纸、碳酸氢钠粉末。实验仪器任选。该方案为________________________________________。