题目内容
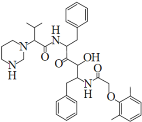
【题目】在0.l mol·L-1的CH3COOH溶液中存在电离平衡:CH3COOH![]() CH3COO-+H+对于该平衡,下列叙述正确的是
CH3COO-+H+对于该平衡,下列叙述正确的是
A. 加入少量CH3COONH4固体,平衡不移动,c(H+)不变
B. 加入少量NaOH固体,平衡向正向移动,溶液中c(H+)减小
C. 加水,平衡向正向移动,c(CH3COOH)/ c(CH3COO-)增大
D. 通入少量 HCl气体,平衡逆向移动,溶液中c(H+)减少
【答案】B
【解析】
A.加入少量CH3COONH4固体,溶液中c(CH3COO-)增大,平衡应逆向移动,但NH4+在溶液中要水解产生H+,结合CH3COONH4溶液显中性,则溶液中c(H+)基本不变,故A错误;
B.加入少量NaOH固体,中和H+,电离平衡正向移动,溶液中c(H+)减小,故B正确;
C.加水,促进电离,平衡向正向移动,溶液中CH3COOH分子数减小,CH3COO-数增大,则c(CH3COOH)/ c(CH3COO-)减小,故C错误;
D.通入少量 HCl气体,c(H+)增大,平衡逆向移动,结合平衡移动原理,最终溶液中c(H+)增大,故D错误;
故答案为B。

 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案【题目】一定温度下,在三个体积均为0.5 L的恒容密闭容器中发生反应:CO(g)+Cl2(g)![]() COCl2(g),其中容器Ⅰ中反应在5 min时达到平衡状态。
COCl2(g),其中容器Ⅰ中反应在5 min时达到平衡状态。
容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | ||
CO | Cl2 | COCl2 | COCl2 | ||
Ⅰ | 500 | 1.0 | 1.0 | 0 | 0.8 |
Ⅱ | 500 | 1.0 | a | 0 | 0.5 |
Ⅲ | 600 | 0.5 | 0.5 | 0.5 | 0.7 |
下列说法中正确的是
A. 容器Ⅰ中前5 min的平均反应速率v(CO)=0.16 mol·L-1·min-1
B. 该反应正反应为吸热反应
C. 容器Ⅱ中起始时Cl2的物质的量为0.55 mol
D. 若起始时向容器Ⅰ加入CO0.8mol、Cl20.8mol,达到平衡时CO转化率大于80%