题目内容
已知反应:FeO(s)+CO(g)= Fe(s)+CO2(g)的Kc=0.5(1273K)。若起始浓度c(CO)=0.05 mol/L,c(CO2)=0.01 mol·L-1,请回答:
(1)判断化学反应进行的方向并计算反应物、生成物的平衡浓度。
(2)CO的转化率是多少?
(3)增加FeO的量,对平衡有无影响?
(1)判断化学反应进行的方向并计算反应物、生成物的平衡浓度。
(2)CO的转化率是多少?
(3)增加FeO的量,对平衡有无影响?
(1)反应将向右进行,CO和CO2的平衡浓度分别为0.04 mol·L-1,0.02 mol·L-1;(2)CO的转换率20%;(3)无影响
考查可逆反应的有关计算。
(1)起始浓度c(CO)=0.05 mol/L,c(CO2)=0.01 mol·L-1,则此时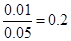 <0.5,所以反应向正反应方向移动。设平衡时消耗CO是x,则平衡时CO是0.05-x,CO2是0.01+x,则根据平衡常数表达式可知
<0.5,所以反应向正反应方向移动。设平衡时消耗CO是x,则平衡时CO是0.05-x,CO2是0.01+x,则根据平衡常数表达式可知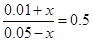 ,解得x=0.01mol/L,所以反应物、生成物的平衡浓度分别是0.04 mol·L-1,0.02 mol·L-1。
,解得x=0.01mol/L,所以反应物、生成物的平衡浓度分别是0.04 mol·L-1,0.02 mol·L-1。
(2)根据(1)可知,CO的转化率是0.01÷0.05=0.2,即转化率是20%。
(3)FeO是固体,改变固体的质量,不会影响平衡状态。
(1)起始浓度c(CO)=0.05 mol/L,c(CO2)=0.01 mol·L-1,则此时
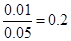 <0.5,所以反应向正反应方向移动。设平衡时消耗CO是x,则平衡时CO是0.05-x,CO2是0.01+x,则根据平衡常数表达式可知
<0.5,所以反应向正反应方向移动。设平衡时消耗CO是x,则平衡时CO是0.05-x,CO2是0.01+x,则根据平衡常数表达式可知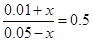 ,解得x=0.01mol/L,所以反应物、生成物的平衡浓度分别是0.04 mol·L-1,0.02 mol·L-1。
,解得x=0.01mol/L,所以反应物、生成物的平衡浓度分别是0.04 mol·L-1,0.02 mol·L-1。(2)根据(1)可知,CO的转化率是0.01÷0.05=0.2,即转化率是20%。
(3)FeO是固体,改变固体的质量,不会影响平衡状态。

练习册系列答案
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案
相关题目
 4 C(g) 2min时反应达到平衡状态(温度不变),并测得C 的浓度为0.4 mol/L,请填写下列空白:
4 C(g) 2min时反应达到平衡状态(温度不变),并测得C 的浓度为0.4 mol/L,请填写下列空白: ,在不同的温度下该反应的平衡常数值分别为:
,在不同的温度下该反应的平衡常数值分别为: CO2(g)+H2(g)
CO2(g)+H2(g) ,判断此时的温度是1000 ℃
,判断此时的温度是1000 ℃ 2C(?)达到平衡,当增大压强时,平衡向逆反应反向移动,则下列情况可能是( )
2C(?)达到平衡,当增大压强时,平衡向逆反应反向移动,则下列情况可能是( ) 2Z(g)此反应达到平衡的标志是
2Z(g)此反应达到平衡的标志是  2Z
2Z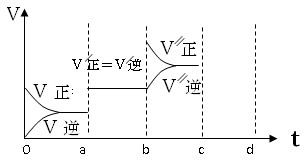
 2SO3,并达平衡后。B容器中SO2的质量分数 (填“ >”、“ < ”或“=”) A 容器中SO2的质量分数
2SO3,并达平衡后。B容器中SO2的质量分数 (填“ >”、“ < ”或“=”) A 容器中SO2的质量分数
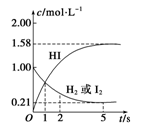
 2HI(g) ΔH=-26.5 kJ·mol-1,测得各物质的物质的量浓度与时间变化的关系如图所示。
2HI(g) ΔH=-26.5 kJ·mol-1,测得各物质的物质的量浓度与时间变化的关系如图所示。